化学实验报告-氯化钠提纯
实验目的
1.通过沉淀反应,了解提纯氯化钠的方法;
2.练习台称和煤气灯的使用以及过滤、蒸发、结晶、干燥等基本操作。
实验原理
粗食盐中含有不溶性杂质(如泥沙)和可溶性杂质(主要是Ca2+、Mg2+、K+和SO42-)。
不溶性杂质,可用溶解和过滤的方法除去。
可溶性杂质可用下列方法除去:在粗食盐溶液中加入稍微过量的BaCl2溶液时,即可将SO42-转化为难溶解的BaSO4沉淀而除去:
Ba2++SO42- = BaSO4
将溶液过滤,除去BaSO4沉淀,再加入NaOH和Na2CO3溶液,由于发生下列反应:
Mg2++2OH- = Mg(OH)2
Ca2++CO32- = CaCO3
Ba2++ CO32- = BaCO3
食盐溶液中的杂质Mg2+、Ca2+以及沉淀SO42-时加入的过量Ba2+转化为难溶的Mg(OH)2,CaCO3,BaCO3沉淀,并通过过滤的方法除去。过量的NaOH和Na2CO3可以用纯盐酸中和除去。少量可溶性的杂质(如KCl)由于含量很少,在蒸发浓缩和结晶过程中仍留在溶液中,不会和NaCl同时结晶出来。
过程步骤
一、粗食盐的提纯
1.在台秤上,称取8g粗食盐,放入小烧杯中,加30ml蒸馏水,用玻璃棒搅动,并加热使其溶解。至溶液沸腾时,在搅动下一滴一滴加入1mol·dm-3BaCl2溶液至沉淀完全(约2ml),继续加热,使BaSO4颗粒长大易于沉淀和过滤。为了试验沉淀是否完全,可将烧杯从石棉网上取下,待沉淀沉降后,在上层清液中加入1-2滴BaCl2溶液,观察澄清液中是否还有混浊现象,如果无混浊现象,说明SO42-已完全沉淀。如果仍有混浊现象,则需继续滴加BaCl2溶液,直到上层清液在加入一滴BaCl2后,不再产生混浊现象为止。沉淀完全后,继续加热五分钟,以使沉淀颗粒长大而易于沉降,用普通漏斗过滤。
2.在滤液中加入1ml2mol·dm-3NaOH和3ml 1mol·dm-3Na2CO3溶液加热至沸。待沉淀沉降后,在上层清液中滴加1mol·dm-3Na2CO3溶液至不再产生沉淀为止,用普通漏斗过滤。
3.在滤液中还滴加入2mol·dm-3HCl,并用玻璃棒沾取滤液在pH试纸上试验,直到溶液呈微酸性为止(pH≈6)。
4.将溶液倒入蒸发皿中,用小火加热蒸发,浓缩至稀粥状的稠液为止,但切不可将溶液蒸发至干。
5.冷却后,用布氏漏斗过滤,尽量将结晶抽干。将结晶移入蒸发皿中,在石棉网上用小火加热干燥。
6.称出产品的质量,并计算产量百分率。
二、产品纯度的检验:取少量(约1g)提纯前和提纯后的食盐。分别用5ml蒸馏水溶解,然后各盛于三支试管中,组成三组,对照检验它们的纯度。
1.SO42-的检验:在第一组溶液中,分别加入2滴1mol·dm-3BaCl2溶液,比较沉淀产生的情况,在提纯的食盐溶液中应该无沉淀产生。
2.Ca2+的检验:在第二组溶液中,各加入2滴0.5mol·dm-3草酸铵(NH4)2C2O4溶液,在提纯的食盐溶液中应无白色难溶的草酸钙CaC2O4沉淀产生。
3.Mg2+的检验:在第三组溶液中,各加入2-3滴1mol·dm-3NaOH溶液,使溶液呈碱性(用pH试纸试验)再各加入2-3滴“镁试剂”,在提纯的食盐溶液中应无天蓝色沉淀产生。
镁试剂是一种有机染料,它在酸性溶液中呈黄色,在碱性溶液中呈红色或紫色,但被Mg(OH)2沉淀吸附后,则呈天蓝色,因此可以用来检验Mg2+的存在。
分析思考
1.怎样除去粗食盐中的杂质Mg2+、Ca2+、K+和SO42-等离子?
2.怎样除去过量的沉淀剂BaCl2、NaOH、Na2CO3?
3.提纯后的食盐溶液浓缩时为什么不能蒸干?
4.怎样检验提纯?
第二篇:化学实验- 物质的检验、分离和提纯
第四节 物质的检验、分离和提纯
【知识网络】
一、物质的分离与提纯方法
混合物的物理分离方法
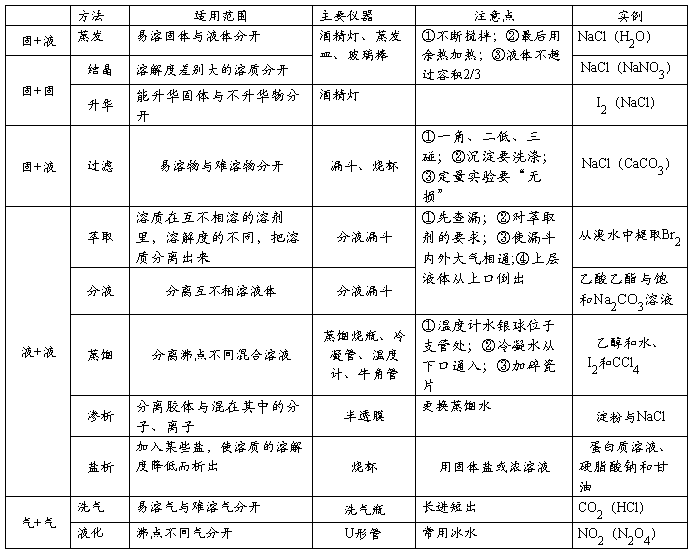
混合物的化学分离法

二、物质的检验

离子检验
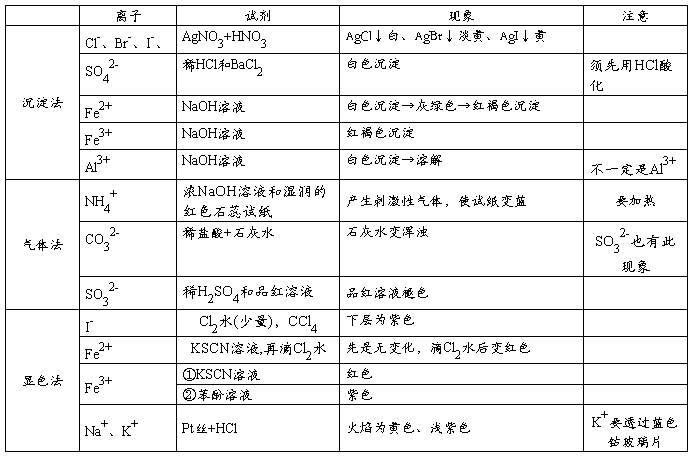
【易错指津】
1.要全面考虑除杂原则。防止虽然除去了原有的杂质,但同时又带进了新的杂质。
2.在解答物质提纯试题时,选择试剂和实验措施应注意三个原则:①不能引入新杂质;②提纯后的物质成分不变;③实验过程和操作方法简单易行。
3.物质提纯和净化时要注意下列几点:①所加试剂和被提纯的物质不能发生化学反应;②所选择的反应要具有较大的不可逆性,即反应要完全,为了使杂质能除尽,所加的试剂要稍过量;③加入的试剂以不引入新的杂质为好;④提纯物易分离。
4.物质的检验要经历方法的选择(包括物理方法和化学方法)、现象的观察及逻辑推理得出结论三个步骤,缺一不可。尽可能选择特效反应以减少干扰。
5.有机物的提纯与分离中很少使用过滤、结晶等方法,较多地使用蒸馏(可分馏)、分液等方法,以及物理与化学的综合法。
在分离提纯有机物时,常犯的错误是套用无机分离中的反应转化法。例如,除去乙酸乙酯中混有的乙酸,如果采用加入乙醇及催化剂并加热的方法,试图将乙酸加转化为乙酸乙酯,这是适得其反的。其一是加入的试剂难以除去;其二是有机反应缓慢、复杂,副反应多,该反应是可逆反应,不可能反应到底将乙酸除尽。
6.缺乏推理判断的能力和方法。
如对不用另加试剂的鉴别题、只用一种试剂的鉴别题、可用多种不同试剂和操作程序的鉴别题,缺乏对解题突破口的确认能力,以及解题程序的安排能力。对图式鉴别题,除了难以寻找突破口以外,对正推法和逆推法的使用,还存在思维障碍。鉴于上述列举的几种情况,因此平时复习解题应重视解题思维的训练,重视思维方法的归纳总结。
【典型例题评析】
例1 下列分离物质的方法中,根据微粒大小分离的是(1996年上海高考题)
A.萃取 B.重结晶 C.沉降 D.渗析
思路分析:渗析是使离子或分子(直径小于10-9m)通过半透膜,能从胶体溶液里分离出来的操作。
答案:D
方法要领:掌握各种分离方法的适用情况。萃取是根据溶质在两种互不溶解的液体中具有不同的溶解度而分离的;重结晶是根据固体物质在水中由于温度不同,溶解度不同的原理分离的操作;沉降是在水中溶解度小而形成沉淀,用过滤法分离;渗析是根据分散质的
微粒小于10-9m可透过透膜的原理而分离的。
例2 只用水就能鉴别的一组物质是(1997年上海高考题)
A.苯、乙酸、四氯化碳 B.乙醇、乙醛、乙酸
C.乙醛、乙二醇、硝基苯 D.苯酚、乙醇、甘油
思路分析:根据物质是否溶于水及比水轻或重来鉴别。B中三种物质均溶于水;C中前二种物质也均溶于水;D中后二种物质均溶于水。只有A中乙酸溶于水,苯和四氯化碳均不溶于水,且苯比水轻,四氯化碳比水重。
答案:A
方法要领:有机物的溶解性有三种情况:①与水混溶,主要是羧酸类和醇;②与水不相溶但比水重,一般是硝基化合物、卤代烃;③与水不相溶但比轻,一般是烃类。分析四组物质便得解。
例3 提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为(20##年全国高考题)
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
思路分析:提纯的基本思路是除杂试剂在除去杂质的同时,不能引入新的杂质。KNO3中含Ba(NO3)2,即除去Ba2+离子,题中给定CO32-或SO42-离子作除杂剂。因过量SO42-离子无法通过HNO3酸化除去,故宜选CO32-离子。
答案:D
方法要领:为使杂质除尽,所加试剂一般会稍为过量,因此一定要注意不引进难除的新杂质,这是做除杂问题时应特别注意的。
例4 只用胶头滴管和试管,不用其他试剂就可以区别的下列溶液(浓度均为0.1mol/L)是 (1999年上海高考题)
A.CaCl2和Na2C03 B.稀H2S04和Na2C03
C.Ba(OH)2和NaHC03 D.NaAlO2和盐酸
思路分析:利用自身间的相互反应(互滴)来鉴别。对于A、C来讲,前者和后者两物质互滴的现象相同:均立即产生沉淀;对B:前者(稀H2SO4)滴入后者(Na2CO3)中,由于首先生成的是NaHCO3,所以开始时无气泡,而将Na2CO3逐滴滴入稀H2SO4中,则马上看到有气体产生,现象互不相同;D中NaAlO2和盐酸互滴的现象也不相同(请读者写出反应的离子方程式),从而可将两种物质区别开来。
答案:B、D
方法要领:不用任何试剂进行鉴别,可采用方法有:(1)连锁推断法。即用某种与众不同的试样作为鉴别用试剂,然后一环扣一环地逐个审;(2)两两组合法。将被检试样两两混合,根据不同现象加以区别;(3)试样互滴法。甲、乙两种试样,根据将甲逐滴滴入乙和将乙逐滴滴入甲的现象不同加以区别。
引申发散:不用任何试剂鉴别多种物质的方法是:(1)先依据外观特征,鉴别出其中的一种或几种,然后再利用它们去鉴别其他的几种物质;(2)若均无明显外观特征,可考虑能否用加热或焰色反应区别;(3)若以上两种方法都不能鉴别时,可考虑两两混合法,记录混合后的反应现象,分析确定。
鉴别物质时,可利用盐的水解。如使用指示剂可鉴别出水解后呈现酸性、碱性和中性的盐溶液;若不用其他试剂,则常用的水解反应是Fe3+与CO32-、HCO3-及Al3+与CO32-、S2-、HCO3-等既产生沉淀又产生气体的双水解反应。
例5 实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用下列操作精制:①蒸馏;②水洗;③用干燥剂干燥;④用10%NaOH溶液洗;⑤水洗,正确的操作顺序是(20##年理综高考题)
A.①②③④⑤ B.②④⑤③① C.④②③①⑤ D.②④①⑤③
思路分析:本题是课本中制溴苯实验的深化。粗溴苯的精制,关键要了解粗溴苯的组成。由于有机反应的不完全性,得到的溴苯中会溶有未反应的苯、溴、三溴化铁(催化剂)并有部分溴化氢。根据粗溴苯的组成,结合它们的理化特性,可设计出如下精制方案:
(1)水洗:利用三溴化铁、溴化氢在水中的溶解度比在有机溶剂中大的特性,使三溴化铁、溴化氢及部分溴进入水层,再分液除去。先用水洗,除去节约下一步操作的用碱量以外,还可以避免FeBr3与碱反应生成难溶性的胶状Fe(OH)3造成分离的困难。
(2)用10%NaOH溶液洗:在分液后得到的油层中加入NaOH溶液,目的使油层中的Br2与NaOH反应,生成可溶于水的NaBr、NaBrO,再经分液除去。
(3)再水洗:用水洗去附着在溴苯表面的钠盐。分液得油层。
(4)加入干燥剂:在(3)分液后的油层中加入无水CaCl2进行干燥,除去油层中的水分。
(5)蒸馏:干燥后的油层的主要成分是溴苯和苯的混合物。由于溴苯与苯的沸点差异较大,故可通过蒸馏的方法获取溴苯。
答案:B
方法要领:重视课本典型物质的制备,要多问几个为什么?。本题要求精制,在明确杂质成分的基础上,先用大量水洗去未反应的苯和溴,再用NaOH除去残余的溴,然后用水洗去残余的NaOH,最后用干燥剂除水并蒸馏。
引申发散:分液和蒸馏是有机物分离和提纯常用的方法。常见情况为:

例6 某溶液含有较多的Na2SO4和少量的Fe2(SO4)3。若用该溶液制取芒硝,可供选择的操作有:①加适量H2SO4溶液,②加金属Na,③结晶,④加过量NaOH溶液,⑤加强热脱结晶水,⑥过滤。正确的操作步骤是(1997年全国高考题)
A.②⑥③ B.④⑥①③ C.④⑥③⑤ D.②⑥①③⑤
思路分析:芒硝是水合硫酸钠晶体,要制取纯净的水合硫酸钠晶体,首先要进行提纯,在此过程中要充分利用原料中的成分,且不能引入新的杂质,要除净Fe3+,加入的NaOH溶液要过量。滤去Fe(OH)3不溶物后,用适量H2SO4溶液中和过量的NaOH,得纯净Na2SO4溶液,浓缩结晶即可。凡有⑤操作都是错误的,因为脱去结晶水就不是芒硝,而是硫酸钠。
答案:B
方法要领:解决本题的关键之一是了解芒硝为何物;关键之二是选择合适的反应物。金属Na虽可直接与水反应生成NaOH,但Na比NaOH贵得多。故应直接用NaOH溶液,保证Fe3+完全转化为Fe(OH)3沉淀滤去,但过量NaOH一定要用适量H2SO4中和。
例7 甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生。据此推断丙物质是(20##年理科综合题)
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeSO4
思路分析:解推断题要抓住特征条件。由题设乙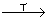 白色沉淀
白色沉淀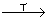 沉淀消失可知,丁必为NaOH,乙必为Al2(SO4)3。(注意:此处隐含实验中试剂的滴加顺序与现象的关系),由此可推及甲为BaCl2,故丙为FeSO4。
沉淀消失可知,丁必为NaOH,乙必为Al2(SO4)3。(注意:此处隐含实验中试剂的滴加顺序与现象的关系),由此可推及甲为BaCl2,故丙为FeSO4。
答案:D
方法要领:关键是抓住乙与丁反应的特征现象——先沉淀后溶解,推出两物质,最后推丙。
例8 在一定条件下,萘可以被硝酸和硫酸的混合酸硝化生成二硝基物,它是1,5-二硝基萘和1,8-二硝基萘的混合物。后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这两种异构体分离。
将上述硝化产物加入适量的98.3%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采用的方法是(1999年浙江省奥赛初赛试题)
A.对所得的滤液蒸发浓缩冷却结晶 B.向滤液中缓缓加入水后过滤
C.向滤液中缓缓加入Na2CO3溶液后过滤 D.将滤液缓缓加入水中后过滤
思路分析:考查学生根据所给信息,利用两种二硝基萘在浓硫酸中溶解度的不同,进行分析、推理的能力。
1,8-二硝基萘可溶于98%的浓硫酸中,1,5-二硝基萘不溶,用耐酸漏斗分离即可。继续将1,8-二硝基萘从浓硫酸中分离出,需要降低硫酸的浓度。如何降低浓硫酸的浓度,则要注意加入水或碱性溶液的方式。
答案:D
方法要领:有的同学会因不注意操作顺序的要求而错选B或C。虽然向滤液中加水或Na2CO3溶液都能达到降低硫酸浓度的目的,但浓硫酸的稀释要注意不可颠倒顺序,即不可将水倒入浓硫酸中。将碳酸钠溶液倒入硫酸中,比水倒入浓硫酸中更危险,因为不仅有水沸腾导致的飞溅,还会有CO2气体逸出时造成的酸液飞溅。
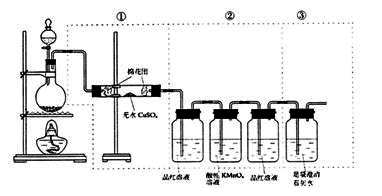
例9 下图虚线框中的装置可用来检验浓硫酸与木炭粉的加热条件下反应产生的所有气体产物,填写下列空白:
(1)如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检验出的物质是 ;不能检出的物质是 。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是 ;不能检出的物质是 。
 (3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是 ;不能检出的物质是 。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是 ;不能检出的物质是 。
思路分析:浓硫酸与木炭加热发生的反应方程式为:2H2SO4+C CO2↑+2SO2↑+2H2O。
纵观整套装置,①用于检验H2O蒸气(使无水硫酸铜变蓝色);②用于检验SO2气(品红溶液褪色、酸性KMnO4溶液褪色,再通过品红溶液验证SO2是否已经除净);③用于检验CO2气(澄清石灰水变浑浊)。
(1)当顺序改为②、①、③时,由于分解气先经②装置,必然带出洗气瓶中H2O的蒸气,故难以肯定①中无水硫酸铜变蓝色是由于浓硫酸与木炭反应所产生的H2O。
(2)当顺序改为①、③、②时,足量澄清石灰水变浑浊究竟是由CO2还是由SO2与Ca(OH)2反应造成的,无法肯定,所以CO2与SO2都无法一一鉴别了。
(3)当顺序改为②、③、①时,出现了(1)中同样的问题。
一个很常见的、平淡的实验,因性质检验装置顺序的调动,检验出学生分析问题的能力,十分巧妙。
答案:(1)SO2、CO2;H2O (2)H2O;CO2、SO2 (3)SO2、CO2;H2O
方法要领:根据SO2、CO2、H2O的特有性质,通过实验来检验三种物质的存在。而在实验过程中,检验SO2、CO2都要通过水溶液,因此对检验H2O(g)有干扰作用;检验CO2用石灰水,SO2也与石灰水反应类似现象,因此SO2也会干扰CO2的检验。三种物质检验时相互有干扰,审题时要搞清气体通过的试剂会与哪种气体反应,从而判断检验出何种气体。
例10 某待测溶液中可能含有Fe2+、Fe3+、Al3+、Ag+、Ba2+、NH4+、Ca2+等离子,进行以下实验(所加酸,碱,氨水,溴水都是过量的).(1992年全国高考题)
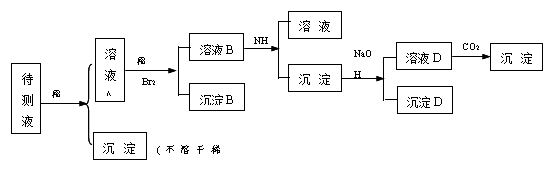
根据实验结果:
(1)判断待测液中有无Ba2+、Ca2+,并写出理由.答:
(2)写出沉淀D的化学式:
(3)写出从溶液D生成沉淀E的反应离子方程式:
思路分析: 待测液中加入HCl得到沉淀A,可断定A为AgCl,Ag+已被除去。向溶液A加入稀硫酸和溴水,若有Fe2+则被氧化成Fe3+(2Fe2++Br2=2Fe3++Br-);由于BaSO4难溶于水,CaSO4微溶于水 ,所以沉淀B为BaSO4和CaSO4的混合物或二者之一。向溶液B中加入氨水得到沉淀C,则沉淀C一定是Fe(OH)3或Al(OH)3或二者的混合物。若沉淀C中含Al(OH)3,则加入过量NaOH溶液时会转变为NaAlO2进入溶液D;沉淀C与过量NaOH溶液作用后仍剩余沉淀D,则可断定D为Fe(OH)3。由于H2CO3的酸性强于HAlO2(可由C、Al在周期表中的位置推出),所以向溶液D中通入CO2得到的沉淀E一定是Al(OH)3,其反应为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
答案:(1)含有Ba2+、Ca2+中的一种或两种;因为BaSO4不溶于水,CaSO4微溶于水 (2)Fe(OH)3 (3)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 。
方法要领:仔细分析每一步所发生的反应,并进行严密的推理和判断(如由所加试剂推测沉淀可能是什么物质、什么物质进入溶液;由肯定的结论验证不肯定的推测,并缩小判断范围;正推和逆推相结合等)是解此类框图题的基本方法。熟悉有关物质的化学性质,并能灵活运用,是解题的基础。
引申发散:在推断混合溶液中肯定存在或肯定不存在的离子时,要注意以下几点:
(1)溶液是否有颜色。某些离子在溶液中具有特殊的颜色:Fe3+——棕黄色,Fe2+——淡绿色,Cu2+——蓝色(CuCl2浓溶液呈绿色)
(2)溶液的酸碱性。从溶液的酸碱性情况可以初步判断某些离子是否存在。
在强酸性溶液中不能大量存在离子有:S2-、SO32-、CO32-、SiO32-、AlO2-等;在强碱性溶液中不能大量存在离子有:NH4+、Mg2+、Al3+、Fe3+、Fe2+、Cu2+、HCO3-、Ag+等。
(3)在判断出肯定存在的离子后,再排除跟该离子在溶液中不可能共存的离子。例如,在已肯定存在SO42-时,就应排除Ba2+的存在。
例11 含苯酚的工业废水处理的流程图如下:(1999年上海高考题)
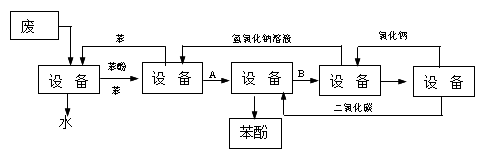
(1)上述流程里,设备Ⅰ中进行的是 操作(填写操作名称)。实验室里这一步操作可以用 进行(填写仪器名称)
(2)由设备Ⅱ进入设备Ⅲ的物质A是 ,由设备Ⅲ进入设备Ⅳ的物质B是 。(3)在设备Ⅲ中发生的化学方程式为
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和 ,通过
操作(填写操作名称)可以使产物相互分离。
(5)上图中能循环使用的物质是C6H6、CaO、 、 。
思路分析:本题属化学与社会、生产相结合的应用型题。在学习苯酚的性质和分离以及酸、碱、盐的化学性质和规律的基础上,将这些知识和规律用于解决生产中的实际问题,目的是培养学生用化学知识解决生活、生产、科技问题的能力和学习化学的方法。
根据题给条件和设计可知:设备Ⅰ用苯萃取废水中的苯酚,生成苯酚的苯溶液(因苯酚易溶于苯而不易溶于水)。设备Ⅱ用于分离苯和苯酚,为此需加入NaOH水溶液,使苯酚变为苯酚钠而溶于水中,再用分液法与苯分离。设备Ⅲ是为了将苯酚钠变为苯酚,考虑到经济成本和环境因素,通入CO2气体较为理想。设备Ⅳ是为了综合利用副产物NaHCO3,加入CaO可转化为反应所需的原料NaOH,而另一生成物CaCO3在设备Ⅴ中又可转化为反应所需的原料CO2和CaO。这样可提高经济效益,降低环境污染。
答案:(1)萃取(或萃取、分液);分液漏斗 (2)苯酚钠(C6H5ONa);NaHCO3 (3)C6H5ONa + CO2+H2O→C6H5OH+ NaHCO3 (4)CaCO3;过滤 (5)NaOH水溶液;CO2
方法要领:本题将化学基础知识应用于生产实际问题中,涉及到中学有机化学中地基本的知识----分离苯和苯酚的混合物。苯酚在冷水中溶解度小,在苯中易溶且苯与水不互溶,故设备Ⅰ中进行的操作是萃取、分液,设备Ⅳ中发生反应:NaHCO3+CaO=CaCO3↓+NaOH,通过过滤操作将与NaOH溶液分离,掌握各种分离方法的适用前提、作用。

例12 A、B、C、D分别代表NaNO 3、NaOH、HNO 3和Ba(NO 3) 2溶液中的一种。现利用另一种溶液X,用下图所示的方法,即可将它们一一确定。试确定A、B、C、D、X各代表何种溶液。(1996年全国高考题)
A: ,B: ,C: ,D: ,X: 。
思路分析:从所给的四物质看,向其中加入某种试剂会产生白色沉淀。可作如下推理:NaNO3溶液很难和其他物质在溶液中产生沉淀。NaOH一般能与多种金属阳离子生成难溶性碱,如:Mg(OH)2、Fe(OH)2(在空气中不易观察),Al(OH)3(两性)。HNO3是强酸,其盐一般均可溶,故在复分解反应中,HNO3除了能跟硅酸盐形成难溶性硅酸外,很难和其他物质产生沉淀。能和Ba(NO3)2形成沉淀的物质应主要从酸根离子考虑,如碳酸盐、亚硫酸盐、磷酸盐、硫酸盐等均能与Ba(NO3)2形成白色沉淀,其中硫酸钡既难溶于水又难溶于酸。
根据以上推理,可将思考问题的范围和角度大大缩小了。产生的沉淀可从难溶性钡盐、氢氧化物和硅酸中考虑。从而确定X的成分。然后在有限的几种可能物质中做一些必要的假设和尝试,检验所做的假设是否合乎题意。
答案:第一组:A:NaOH B:NaNO3 C:Ba(NO3)2 D:HNO3 X:MgSO4
第二组:A:HNO3 B:NaNO3 C:Ba(NO3)2 D:NaOH X:Na2SiO3
方法要领:本题对物质的性质和离子反应的知识借助于化学实验的形式进行考查。解题思路是结合已知物质的性质,综合全面地分析出与X反应产生白色沉淀的各种可能,最后通过归纳,总结得出几种可能,再经过验证得出结论。
注意白色沉淀除了常见的难溶性的钡盐和氢氧化物外,还有硅酸沉淀(这样可得出第二组答案)。再者注意检验,否则即使推断正确,也会造成书写结果的错误。
