实验名称:二氧化碳相对分子质量的测定
实验日期: 温度: 气压:
一、实验目的
1.学习气体相对密度法测定相对分子质量的原理和方法
2.加深理解理想气体状态方程式和阿伏加德罗定律
3.巩固使用启普气体发生器和熟悉洗涤,干燥气体的装置
二、实验原理
根据阿伏加德罗定律,在同温同压下,同体积的如何气体含有相同数目的分子。
对于P,V,T相同的A,B两种气体。若以mA,mB分别代表A,B两种气体的质量,mA,mB分别代表A,B两种气体的摩尔质量。其理想气体状态方程式分别为:
气体A:PV=(mA/MA)*RT (1)
气体B:PV=(mB/MB)*RT (2)
由(1)(2)并整理得 mA:mB=MA:MB
于是得出结论:在同温同压下,同体积的两种气体的质量之比等于其摩尔质量之比,由于摩尔质量数值就是该分子的相对分子质量,故摩尔质量之比也等于其相对分子质量之比。
因此我们应用上述结论,以同温同压下,同体积二氧化碳与空气在相对条件下的质量,便可根据上式求出二氧化碳的相对分子质量。
即Mr,CO2=(mCO2/m空气)*29.0 式中,29.0是空气的相对分子质量。式中体积为V的二氧化碳质量mCO2可直接从分析天平上称出。同体积空气的质量可根据实验时测得的大气压P和温度T,利用理想气体状态方程式计算得到。
三、基本操作
1.启普发生器的安装和使用方法,参见第五章一
2.气体的洗涤,干燥和收集方法,参见第五章二,三
四、实验内容
按图把装置连接装备——制取二氧化碳的实验装置。因石灰石中含有硫,所以在气体发生过程中有硫化氢,酸雾,水汽产生。此时可通过硫化铜溶液,碳酸氢钠溶液以及无水氯化钙除去硫化氢,酸雾,水汽。
取一洁净而干燥的磨口锥形瓶,并在分析天平上称量(空气+瓶+瓶塞)的质量。
在启普发生器中产生二氧化碳气体,经过净化,干燥后导入锥形瓶中。由于二氧化碳气体略重于空气,所以必须把导管插至瓶底。等4至5分钟后,轻轻取出导管,用塞子塞住瓶口。在锥形瓶颈上记下塞子下沿的位置。在分析天平上称量(二氧化碳+瓶+瓶塞)的总质量。重复通二氧化碳气体和称量的操作,直到前后两次称量的质量相符为止(两次质量可相差1至2mg)。最后在瓶内装入水,使水的液面和瓶颈上的标记相齐,在托盘天平上称量出(锥形瓶+水+瓶塞)的质量。
五、数据记录和结果处理(表中的数据仅供参考)
数据的数位很重要,用分析天平所称量的质量保留小数后四位,托盘天平只需保留小数后一位。

第二篇:无机化学实验五 二氧化碳相对分子质量的测定
实验五 二氧化碳相对分子质量的测定
一、实验目的
1.学习气体相对密度法测定分子量的原理和方法,加深理解理想气体状态方程式和阿佛加德罗定律;
2.学会大气压力计的使用;
3.巩固分析天平的使用;
4.了解启普发生器的构造和原理,掌握其使用方法,熟悉洗涤、干燥气体的装置。
二、实验原理
阿佛加德罗定律:同T、P,同V的气体物质的量相等
理想气体状态方程式:PV= nRT = mRT/M
对同T、P,同V的空气(air)和二氧化碳(CO2)有 :
= 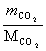
式中,m,M分别为空气(二氧化碳)的质量和相对分子质量
则,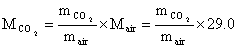
[教学重点]
分析天平的使用
启普发生器的使用
分子量的测定和计算
[教学难点]
分析天平的称量操作
启普发生器的使用
[实验用品]
仪器:台秤(电子称)、分析天平、启普发生器、洗气瓶、锥形瓶、干燥管
药品:石灰石、无水CaCl2、6mol·L-1HCl、1mol·L-1NaHCO3、1mol·L-1CuSO4
材料:玻璃棒、玻璃导管、橡皮塞(3、6、8~12号)、玻璃棉
[基本操作]
一、大气压力计的使用方法
1.首先观察附属温度计,记录温度;
2.调节水银槽中的水银面。旋转调节螺旋使槽内水银面升高,这时利用水银槽后面白磁片的反光,可以看到水银面与象牙针的间隙,再调节螺旋至间隙恰好消失为止;
3.调节游标。转动控制游标的螺旋,使游标的底部恰与水银柱凸面顶端相切;
4.读数方法。读数标尺上的刻度单位为hPa。整数部分的读法:先看游标的零线在刻度标尺上的位置,如恰与标尺上某一刻度相吻合,则该刻度即为气压计读数。例如,游标零线与标尺上1160相吻合,气压读数即为1161.0 hPa,如果游标零线在1161与1162之间,则气压计读数的整数部分即为1161,再由游标确定小数部分。小数部分的读法:从游标上找出一根与标尺上某一刻度相吻合的刻度线,此游标读数即为小数部分,如1161.5 hPa;
5.读数后转动气压计底部的调节螺旋,使水银面下降到与象牙针完全脱离;
6.做仪器误差、温度、海拔高度和纬度等项校正。
二、电子天平的使用
1.电子天平的使用精确度0.1 mg (最大载荷200 g)
(1)使用前观察天平仪是否水平,如不水平,用水平脚调整水平;
(2)接通电源,预热20~30 min以获得稳定的工作温度;
(3)让秤盘空载并轻按“On”键,天平显示自检(所有字段闪现等),当天平回零时,就可以称量了;
(4)简单称量:打开天平侧门,将样品放在秤盘上,关闭侧门,等到稳定指示符“。”消失,读取称量结果;
(5)去皮称量:将空容器放在秤盘上,显示其重量值。轻按“→O/T←”键去皮。向空容器中加料,并显示净重值(如将容器从天平上移去,去皮重量值会以负值显示,此值将一直保留到再次按“→O/T←”键或关机。);
(6)称完,取下被称物,按一下OFF键,拔下电源插头,盖上防尘罩。
2.电子天平的使用规则与维护
(1)天平室应避免阳光照射,保持干燥,防止腐蚀性气体的侵袭。天平应放在牢固的台上避免震动;
(2)天平箱内应保持清洁,要定期放置和更换吸湿变色干燥剂(硅胶),以保持干燥;
(3)称量物体不得超过天平的载荷;
(4)不得在天平上称量热的或散发腐蚀性气体的物质;
(5)开关天平要轻缓,以免震动损坏天平的刀口。在天平开启(全开)状态严禁加减砝码和物体;
(6)使用电光分析天平加减砝码时,必须用镊子夹取,取下的砝码应放在砝码盒内的固定位置上,不能乱放,也不能够用其它天平的砝码;
(7)称量的样品,必须放在适当的容器中,不得直接放在天平盘上;
(8)称量完毕应将各部件恢复原位,关好天平门,罩上天平罩,切断电源。并检查盒内砝码是否完整无缺和清洁,最后在天平使用登记本上写清使用情况。
三、启普发生器的构造与使用
构造:葫芦状容器,球形漏斗,旋塞导管,塞子。
实验室中常常利用启普发生器制备H2、CO2、H2S等气体。启普发生器不能受热,装在发生器内的固体必须是颗粒较大或块状的。移动时,应用两手握住球体下部,切勿只握住球形漏斗,以免葫芦状容器落下而打碎。
使用:
1.装配:在球形漏斗和玻璃旋塞磨口处涂一薄层凡士林油,插好球形漏斗和玻璃旋塞,转动几次,使其严密。
2.检查气密性: 开启旋塞,从球形漏斗口注水至充满半球体时,关闭旋塞。继续加水,待水从漏斗管上升到漏斗球体内,停止加水。在水面做记号,静置片刻,如水面不下降,证明不漏气,可以使用。
3.加试剂:从导气管口加入固体试剂,从球形漏斗加入酸。
4.发生气体:打开旋塞,固液接触产生气体;关闭旋塞,由于气体的压力使液体与固体分离,反应停止。
5.添加或更换试剂:从下口排出废液,从从漏斗口添加液体;从导气管口加入固体。
6.结束后处理:关闭旋塞,使反应停止,将废液倒入废液桶,固体倒出洗净回收,磨口部分垫上纸条。
三、实验内容
(一)CO2的制备及称量

1.按图搭好制取CO2的装置,检查气密性;
2.称量:锥形瓶+橡皮塞+空气(用笔在皮塞上做记号)的质量,台秤粗称,分析天平准确称量(称准至0.1 mg),记为m1;
3.制备CO2气体并收集,检验是否收满(3~5 min);
4.称量:锥形瓶+橡皮塞+CO2的质量,分析天平准确称量,记为m2(重复两次取平均值);
5.称量:锥形瓶+橡皮塞+H2O的质量,台秤粗称(称准至0.1 g),记为m3。
(二)数据记录与处理
室温T = K气压P = Pa
m1(空气+瓶+塞子) = g
第一次称m2(CO2+瓶+塞子) = g
第二次称m2(CO2+瓶+塞子) = g
平均m2 = g
m3(H2O+瓶+塞) = g
瓶子体积V = m3–m1/1.00 = mL = m3
(这一步为近似计算,忽略了空气质量.)
瓶内空气的质量
mair= 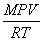 = g
= g
(瓶+塞)m4= m1- m空气= g
m CO2= m2- m4= g
MCO2 = 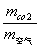 ×29.0 =
×29.0 =
(三)计算误差
绝对误差(E)=测定值(x) -真实值(xT) =
相对误差=  × 100% =
× 100% =
误差越小(大),准确度越高(低);结果偏高(低),正(负)误差。
四、注意事项
1.气压计的正确读数;
2.电子天平的正确使用;
2.启普发生器中酸不可多装,以防酸过多把导气管口淹没;
3.碳酸钙不要加太多,占球体的1/3即可;
4.保持塞子塞入瓶中的体积相同。
五、问题讨论
1.为什么二氧化碳气体、瓶、塞的总质量要在分析天平上称量,而水+瓶+塞的质量可在台秤上称量?两者的要求有何不同?
2.为什么橡皮塞塞入的位置要用笔做记号?
3.分析误差产生的原因?
4.哪些物质可用此法测定相对分子质量?哪些不可以?为什么?
