实验名称:醋酸解离和解离常数的测定——pH计的使用
实验日期: 温度: 气压:
一、实验目的
1.测定醋酸的解离度和解离常数
2.掌握滴定原理,滴定操作及正确判断滴定终点
3.学习使用pH计
二、实验原理(详见课本P139)
三、基本操作
1.滴定管的使用,参见第四章二
2.移液管,吸量管的使用,参见第四章二
3.容量瓶的使用,参加第四章二
4.pH计的使用,参见第七章一
四、实验内容
1.醋酸溶液浓度的测定
以酚酞为指示液,用已知浓度的氢氧化钠标准溶液标定HAc溶液的标准浓度,把结果填入下表。

2.配制不同浓度的HAc溶液
用移液管和吸量管分别取25.00ml,5.00ml,2.50ml已测定得准确浓度的HAc溶液,把它们分别加入三个50ml容量瓶中,再用蒸馏水稀释至刻度,摇匀,并计算出这三个容量瓶中HAc溶液的准确浓度。(数据仅供参考)
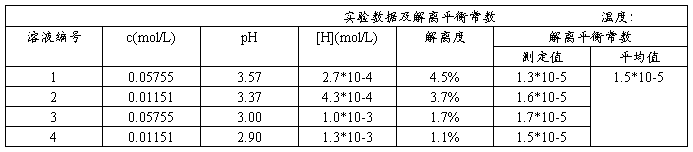
3.测定醋酸溶液的pH,计算醋酸的解离度和解离平衡常数
把以上四种不同浓度的HAc溶液分别加入四只洁净干燥的50ml烧杯中,按稀到浓的次序在pH计上分别测定它们的pH,并将有关数据填入表中:

五、实验习题
1.以氢氧化钠标准装入碱式滴定管中滴定待测HAc溶液,以下情况对滴定结果有何影响?
1) 滴定过程中滴定管下端产生了气泡;偏小
2) 滴定近终点时,没有用用蒸馏水冲洗瓶的内壁;偏大
3) 滴定完后,有液滴悬挂在滴定管的尖端处;偏大
4) 滴定过程中,有一些滴定液自滴定管的旋转塞处渗漏出来。偏大
第二篇:电导滴定法测定醋酸的解离常数
电导滴定法测定醋酸的解离常数
一、实验目的
1.熟悉电导滴定法的基本原理;
2.掌握电导滴定法测定弱酸解离常数的实验方法。
二、实验原理
溶液的电导随离子的数目、电荷和大小而变化,也随着溶剂的某些特性如粘度的变化而变化。这样可以预料,不同品种的离子对给定溶液产生不同的电导。因此,如果溶液里一种离子通过化学反应被另一种大小或电荷不同的离子取代,必然导致溶液的电导发生显著变化。电导滴定法正是利用这一原理完成欲测物质的定量测定。
一个电解质溶液的总电导,是溶液中所有离子电导的总和。即:
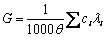 (2-1)
(2-1)
式中ci为第i种离子的浓度(mol?L-1),λi为其摩尔电导,θ为电导池常数。
弱酸的解离度α与其电导的关系可表示为:
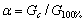 (2-2)
(2-2)
Gc为任意浓度时实际电导值,它是从实验中实际测量的,G100%为同一浓度完全解离时的电导值,它可从不同的滴定曲线计算而得。
醋酸在溶液中的解离平衡为:
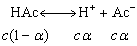
解离常数Ka为:
 (2-3)
(2-3)
根据电解质的电导具有加和性的原理,对任意浓度醋酸在完全解离时的电导值,能从有关滴定曲线上求得。假如选用氢氧化钠滴定醋酸和盐酸溶液,可从滴定曲线上查得有关电导值后,按下式计算醋酸在100%解离时的电导值。
 (2-4)
(2-4)
式中GNaAc为醋酸被氢氧化钠滴定至终点的电导值,GNaCl为盐酸被滴定至终点的电导值。(注意:所述电导值应按式(2-1)校正至相同的物质的量浓度,式(2-4)才成立)。
三、仪器与试剂
1.DZDS-A电导仪(南京多助科技发展有限公司);
DJ51C型电导电极(铂黑电极)(南京多助科技发展有限公司);
2.电磁搅拌器(78-1磁力加热搅拌器)(金台市富华仪器有限公司);
3.碱式滴定管(50ml);
4.NaOH标准溶液:0.2000mol?L-1;
醋酸溶液:~0.1mol?L-1;
盐酸溶液:~0.1mol?L-1。
四、实验步骤
1.预热电导仪,联接电导电极。
2.醋酸电导测定
(1)溶液配制;
移取约0.1mol?L-1醋酸溶液20mL于300mL的烧杯中,加蒸馏水170mL,放烧杯在电磁搅拌器上,插入洗净的电导电极,注意不能影响搅拌磁子的转动。开动电磁搅拌器,调节搅拌速度,使溶液不出现涡流。
用NaOH标准溶液(0.2000mol?L-1)润洗碱式滴定管1-2次;装入50ml NaOH标准溶液;
(2)测定;
将电导仪参数低周、高周按下调至低周;实际测量、温度补偿调至实际测量。按下切换键,当显示OVER后开始测定。
用0.2000mol?L-1 NaOH标准溶液滴定,首先记录醋酸未滴定时的读数,然后每次滴定0.5mL,读一次电导数值,直到滴定剂约20mL体积。记录测定数据。
3.盐酸电导测定
(1)溶液配制;
移取约0.1mol?L-1盐酸溶液20mL于300mL的烧杯中,加蒸馏水170mL,放烧杯在电磁搅拌器上,插入洗净的电导电极,注意不能影响搅拌磁子的转动。开动电磁搅拌器,调节搅拌速度,使溶液不出现涡流。
用NaOH标准溶液(0.2000mol?L-1)润洗碱式滴定管1-2次;装入50ml NaOH标准溶液;
(2)测定;
同步骤3,用0.2000mol?L-1 NaOH标准溶液滴定约0.1mol?L-1盐酸溶液,直到滴定剂约20mL体积。记录测定数据。
五、数据处理
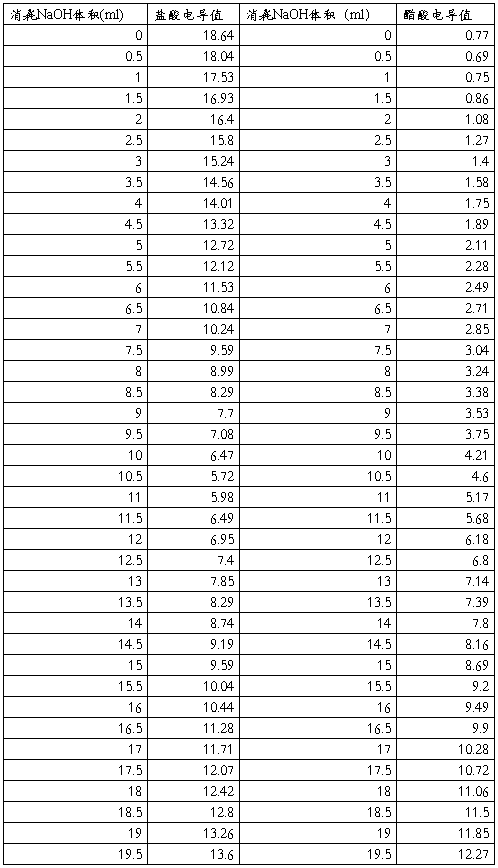
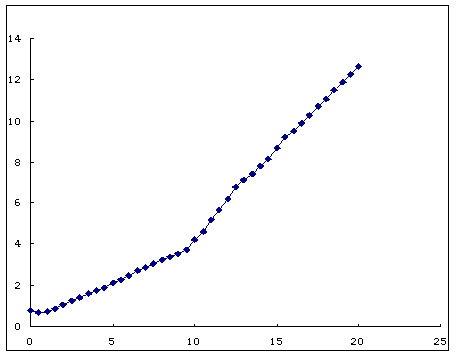 1.绘制醋酸和盐酸的电导滴定曲线。
1.绘制醋酸和盐酸的电导滴定曲线。
醋酸电导滴定曲线(9.5 3.75)
盐酸的电导滴定曲线(10.5 5.72)
2.从两种滴定曲线的终点所消耗的NaOH体积,分别计算醋酸和盐酸的准确浓度。
醋酸终点所消耗的NaOH体积9.5ml
9.5×0.2÷20=0.095
醋酸的准确浓度=0.095 mol?L-1
盐酸终点所消耗的NaOH体积10.5ml
10.5×0.2÷20=0.105
盐酸的准确浓度=0.105mol?L-1
3.按方法原理中公式(2-1),校正GNaAc、GHCl和GNaCl与GHAc相同的物质的量浓度时的数值,再按式(2-4)求醋酸在100%解离时电导值,进而从式(2-2)和式(2-3)计算出醋酸的解离常数Ka。
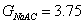
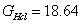
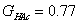
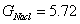
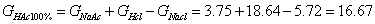
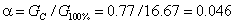
 依据醋酸在溶液中的解离平衡为:
依据醋酸在溶液中的解离平衡为:
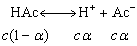
公式:

得醋酸在溶液中的解离常数Ka为:0.000224=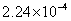 .
.
六、问题讨论
1.解释用NaOH滴定HAc和HCl的电导滴定曲线为何不同?
答:对强电解质而言,溶液浓度降低,摩尔电导率增大,这是因为随着溶液浓度的降低,离子间引力变小,粒子运动速度增加,故摩尔电导率增大。
对弱电解质而言,溶液浓度降低时,摩尔电导率也增加。在溶液极稀时,随着溶液浓度的降低,摩尔电导率急剧增加。
因为HAC是弱酸 ,HCL是强酸 ;强酸强碱盐不会水解, 弱酸强碱盐(这里是NaAC)会水解导致的。
2.本实验所用方法测定弱酸的解离常数Ka,有哪些特点?
答:利用电导值计算离子活度,
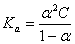
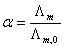 根据电离学说,可以认为,弱电解质的电离度α等于在浓度时的摩尔电导Λ与溶液在无限稀释时的电导
根据电离学说,可以认为,弱电解质的电离度α等于在浓度时的摩尔电导Λ与溶液在无限稀释时的电导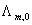 之比,即
之比,即
3.如要准确测定Ka值,在滴定实验中应着重控制哪些影响因素?
答:电解质溶液导电主要与电解质的性质,溶剂的性质,测量环境的温度,电解质溶溶液的浓度及离子的价数有关。
在测量时注意温度变化;
在每次测量后都要将电极清洗干净;
准确滴定,滴定过程中一定要每次0.5ml准确滴定。
