物质的分离与提纯——物理方法
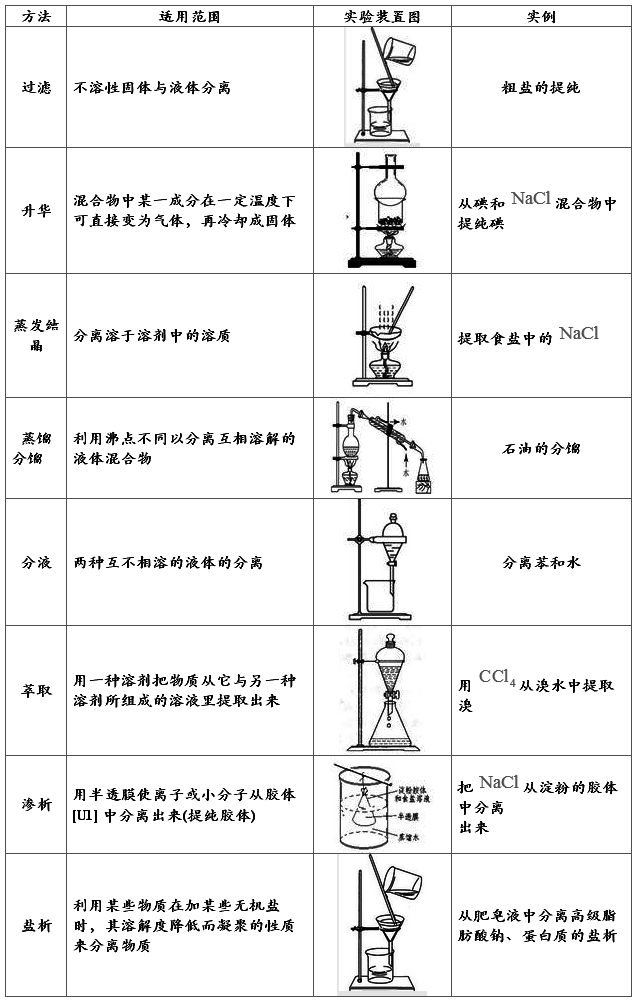
注意事项:(1)物质的分离、提纯方法的选择应遵循步骤最少、操作简单、
除杂彻底、切实可行的原则。
(2)一般情况下,整个提纯过程是多种方法联合使用,此时要
注意采用方法的先后顺序。
[U1]
胶体是一种介于溶液和浊液之间且高度分散的多相不均匀体系。例如:蛋白质胶体、淀粉胶体等。
第二篇:物质的分离和提纯与鉴别方法归纳
化学平衡常数解题妙用例析
黑龙江省庆安县第一中学 孙秀民
化学平衡是化学反应原理中非常重要的知识之一,化学平衡常数是解决化学平衡问题的一种重要的手段和方法,如果平衡常数运用恰当,会得到事半功倍的效果。现从以下几个方面介绍平衡常数在解题中的妙用。
一、判断反应进行的程度
K值越大,正反应进行的程度越大,反应物的转化率越高;K值越小,正反应进行的程度越小,反应物的转化率越低。
【例1】下列数据是一些反应的平衡常数,请判断:表示反应进行得最接近完全的是( )
3-105A.K=3×10 B. K=2×10 C. K=3×10 D. K=2×1010
【答案】D
【解析】K值越大,正反应进行得越完全。一般认为K>105时,即反应基本完成,故选D。
二、判断反应的热效应
K值只受温度影响,与浓度、压强和是否使用催化剂无关。温度越高,K值越大,则正反应为吸热反应;温度越高,K值越小,则正反应为放热反应。
--【例2】I2在KI溶液中存在下列平衡:I2(aq)+I(aq)I3(aq),某 I2、KI混合溶液中,
--I3的物质的量浓度c(I3)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
--A.反应I2(aq)+I(aq)=I3(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
【答案】BC
-【解析】根据题中图示可知,c(I3)是随着温度T 的升高而减小的,说明:

I2(aq)+I(aq)I3(aq) 是一个放热反应,即△H<0 ,所以A错误;根据平衡移动规-律,c(I3)变小,则c(I2)应变大,所以 状态B的c(I2)大,所以D错误;正确答案为B、C。
三、判断反应进行的方向
勒夏特列原理定义中减弱一词的含义较难理解,可如果我们使用化学平衡常数通过计算,定量进行比较,可以较好的突破平衡移动方向的判断这个难点。所以,平衡常数是将化学平衡移动原理定性的判断转化为定量的计算,从而使判断平衡移动更为准确。甚至用勒夏特列原理无法解释的问题,用平衡常数也可以快速的解决。
对任意一个可逆反应:mA+nB pC+qD,其平衡浓度的比值,总是符合下列关
系
--
(是一个定值,称为化学平衡常数。)
若用Qc表示任意状态下,可逆反应中产物的浓度以其化学计量系数为指数的乘积与反应物的浓度以其化学计量系数为指数的乘积之比,则这个比值称为浓度商。将浓度商和平衡常数作比较可得可逆反应所处的状态。即:
Qc = Kc 体系处于化学平衡
Qc<Kc 反应正向进行
Qc>Kc 反应逆向进行
可见只要知道一定温度下,某一反应的平衡常数,并且知道反应物及产物的浓度,就能判断该反应是平衡状态还是向某一方向进行。
【例3】在一定温度条件下,对于已达到平衡的可逆反应: FeCl3+3KSCN
3KCl+Fe(SCN)3,在此溶液中作如下处理,化学平衡逆向移动的是( )
A.加入少量的KCl固体 B.加入少量FeCl3固体
C.减少Fe(SCN)3的浓度 D.加水稀释
【答案】D
【解析】该反应的本质是Fe3++3SCN-Fe(SCN)3,任意时刻的浓度商为
。因为KCl没有参加反应,因此改变KCl的量不会影响到平衡的移动,故
A项错误;加入少量FeCl3固体或减少Fe(SCN)3的浓度,均会使Qc<K,平衡正向移动,故B、C均错误;加水稀释,使c(Fe3+)、c(SCN-)和c(Fe(SCN)3)的浓度均减小,但c(Fe3+)·c(SCN-)减小的更快,使Qc>K,平衡逆向移动,故D正确。
四、计算转化率
利用温度不变时,化学平衡常数不变的关系,列方程求解。
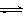
CO2(g)+H2(g),若【例4】已知在800K时,反应:CO(g)+H2O(g)
起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%。若将H2O的起始浓度加大为6mol/L,试求CO转化为CO2的转化率。
【答案】75%
【解析】本题考查平衡常数表达式、有关计算及应用。
先由第一次平衡时CO的转化率可求平衡时各物质的浓度:
c(CO)=0.8mol/L, c(H2O)=1.8 mol/L, c(CO2)=1.2 mol/L, c(H2)=1.2 mol/L;再由此求K值:K=。
假设第二次平衡时,CO的转化浓度为x,则
CO(g) + H2O(g)CO2(g) + H2(g)
起始浓度 mol/L 2 6 0 0
转化浓度 mol/L x x x x
平衡浓度 mol/L 2-x 6-x x x
因温度不变,故平衡常数不变,则有
故CO的转化率为:。 ,解得:x=1.5mol/L。
通过以上几个案例的分析,可以看出化学平衡常数是解答化学平衡问题的重要工具,其用途可概括为直接应用和综合应用两个方面。通过平衡常数可以直接判断一个反应进行的程度,也可以间接地通过平衡常数来判定反应的热效应和反应进行的方向,以及用平衡常数进行各种计算,求某些特定物质的转化率或浓度等。
【练习】
1、在某温度下,可逆反应mA(g)+nB(g)
确的是( )
A. K越大,达到平衡时,反应进行的程度越大
B. K越小,达到平衡时,反应物的转化率增大
C. K随反应物浓度的改变而改变
D. K随温度的改变而改变
2、在一密闭容器中,aA(g)bB(g)达平衡后温度保持不变,将容器体积增加一倍,当pC(g)+qD(g)的平衡常数为K,下列说法正达到新的平衡时,B的浓度是原来平衡时浓度的60%,则:( )
A. 平衡向正反应方向移动了 B. 物质A的转化率减少了
C. 物质B的质量分数增加了 D. a>b
3、在373K时,把0.5molN2O4气体通入体积为5L的真空密闭容器中,立即出现棕色,反应进行到2s时,浓度为0.02mol/L,在60s时,体系已达到平衡,此时容器内压强为开始时的1.6倍,下列说法正确的是( )
A. 前2s,以N2O4的浓度变化表示的平均反应速度为0.01mol/(L·s)
B. 在2s时容器内压强为开始时压强的1.1倍
C. 在平衡体系内含N2O40.25mol
D. 平衡时,如果压缩容器体积,则可提高N2O4的转化率
4、在一密闭容器中,等物质的量的X和Y发生如下反应:X(g)+2Y(g) 2Z(g),反应达到平衡时,若混合气体中X和Y的物质的量之和与Z的物质的量相等,则X的转化率为( )
A. 10% B、50% C、60% D、70%
5、在一密闭的容器中,将一定量的NH3加热使其发生分解反应:2NH3(g) N2(g)+3H2(g),当达到平衡时,测得25%的NH3分解,此时容器内的压强是原来的( )
A、1.125倍 B、1.25倍 C、1.375倍 D、1.50倍
6、在一定温度下,将1molCO和1mol水蒸气放入一固定容积的密闭容器中,发生反应CO(g)+H2O (g)
A、0.9mol B、0.8mol C、0.7mol D、0.6mol
7、将0.4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)
②用物质B表示的反应的平均速率为0.6mol·(L·s)1 -CO2(g)+H2(g),达平衡状态后,得到CO20.6mol;再通入0.3mol水蒸气,达到新的平衡状态后,CO2的物质的量可能是( ) 2C(g),若经2s后测得C的浓度为0.6mol·L1,现有下列几种说法:--①用物质A表示的反应的平均速率为0.3mol·(L·s)1
③2s时物质A的转化率为70%
-④2s时物质B的浓度为0.7mol·L1
其中正确的是( )
A、①③ B、①④ C、②③ D、③④
8、在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应:
2R(g)+5Q(g)
A、2 B、3 C、4 D、5
9、某容器中加入N2和H2,在一定条件下,N2+3H2
A、5mol/L B、10mol/L C、8mol/L D、6.7mol/L
10、已知下列反应的平衡常数:H2(g)+S(s)
S(s)+O2(g)
则反应H2(g)+SO2(g) SO2(g) K2 O2(g)+H2S(g)的平衡常数是 ( ) H2S(g) K1 2NH3,达到平衡时N2、H2、4X(g)+nY(g),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是( ) NH3的浓度分别是3mol/L、4mol/L、4mol/L,则反应开始时H2的浓度是 ( )
A、K1+ K2 B、K1 -K2 C、K1 ×K2 D、K1/K2
11、有可逆反应2A(g)+2B(g)
(1)该反应的化学平衡常数的表达式可表示为 。
(2)该反应选用了一种合适的催化剂,发现反应温度在100℃~400℃的范围内,每高10℃,反应速度为原来的3倍,在400℃~450℃时,每高10℃,反应速度却约为原来的10倍,而温度高于450℃时,反应速度却约为原来的3倍,若其它反应条件不变,试分析造成这种现象的原因 。
(3)若该反应在固定容积的密闭容器中进行,并保持温度不变。往容器里充入等物质的量的A、B两种气体物质,反应进行5min后,试推测容器内的压强可能发生的变化 。(填正确的字母编号)
A、增大 B、减小 C、不变
其理由是 。
(4)若该反应在恒温下进行并已达平衡,再维持温度不变,将压强由100kPa增大到500kPa平衡发生了移动,但却发现平衡向左移动,你是否怀疑勒夏特列原理对平衡系统的
普遍适用性? ;试写出你的分析理由 2C(g)+D(g)
。
12、平衡常数K的数值大小是衡量化学反应进行程度的标志,在25℃时,下列反应式及其平衡常数:
2NO(g)
N2(g)+O2(g) K1=1×1030
2H2O(g) K2=2×1081
-92 2H2(g) +O2(g) 2CO2(g)
2CO(g)+O2(g) K3=4×10
(1)常温下NO分解产生O2的反应的平衡常数表达式为 。
(2)常温下水分解产生O2,此时平衡常数值约为 。
(3)常温下NO、H2O、CO2三种化合物分解放出氧气的大小顺序为:
(4)随着轿车进入家庭,汽车尾气污染成为备受关注的环境问题,市政府要求全市对所有汽车尾气处理装置完成改装,以求基本去除氢氧化物、一氧化碳污染气体的排放。而改装后的尾气处理装置主要是加入了有效催化剂,请你根据以上有关数据分析,仅仅使用催化剂
13、可逆反应CO+H2O
=2.60,问:
(1)当CO起始浓度为2mol/L,H2O起始浓度为2mol/L时,CO的转化率为多少?
(2)当CO起始浓度仍为2mol/L,H2O的起始浓度为6mol/L时,CO的转化率为多少?
14、在接触法制硫酸中,将SO2与空气按1:3的体积比混合(空气中氮气与氧气的体积比为4:1)后进入接触室,在一定条件下反应达到平衡后,气体总体积减少为原来的88%(体积均在相同情况下测定),试求:
(1)反应达到平衡时SO2的转化率;
(2)若生成的SO3可在吸收塔中完全被吸收,则排出的尾气中SO2的体积百分含量。 CO2+H2在密闭容器中建立了平衡。当温度为749K时,Kc
15、在673K,1.01×105Pa时,有1mol气体A发生如下反应:2A(g)
质量为46g,密度为0.72g·L1。求: -xB(g)+C(g)。在一定条件下已达到平衡。在平衡混合气体中,A占其体积百分比为58.84%。混合气体总
(1)平衡混合气体的平均相对分子质量;
(2)A的平衡转化率;
(3)x值
(4)相同条件下,反应前A的密度是平衡混合气体密度的几倍。
参考答案:
1.AD 2.AC 3.B 4.A 5.B 6.C 7.B 8.A 9.B 10.D
11.(1) (2)催化剂在400℃~450℃活性最大 (3)B;在该条件下,发生反应的气体体积减小,压强减小 (4)不;可能反应物中某物质的状态发生改变。
12. (1)
(2) 2×10-11 (3)NO;H2O;CO2 (4)能
13、61.7%,86.6% 14、96%,1.56%
15、(1)39.73 (2)A的转化率为32% (2)x=2 (4)反应前A的密度是平衡混合气体密度的1.16倍。
