磁化率-络合物的测定
本实验对磁介质在磁场中的磁化现象进行了探讨,并通过对一些物质的磁化率的测定,求出未成对电子数并判断络合物中央离子的电子结构和成键类型。此外,加强了对古埃法测定磁化率原理和技术的理解及学习使用了磁天平。
磁化率是各种物质都普遍具有的属性。考察组成物质的分子:如果分子中的电子都是成对电子,则这些电子对的轨道磁矩对外加磁场表现出“抗磁性”或“反磁性”,该物质的磁化率将是一个负值,其数量级约10-5~10-6emu。但是如果分子中还存在非成对电子,那么这些非成对电子产生的磁矩会转向外磁场方向,并且这种效应比产生“抗磁性”的楞次定律效应强很多,完全掩盖了成对电子的“抗磁性”而表现出“顺磁性”,其磁化率是正值,数量级约10-2~10-5emu。原子核的自旋磁矩也会产生顺磁效应,不过核顺磁磁化率只有约10-10emu,一般不予考虑。
上述的顺磁性和抗磁性均为弱磁性,其相应的磁化率都远小于1;还有一种“铁磁性”,其磁化率远大于1——被称为强磁性。弱磁性和强磁性还有一个显著区别是:弱磁性物质的磁化率基本上不随磁场强度而变化,强磁性物质的磁化率却随磁场强度而剧烈变化。
可见,测量磁化率可以区分物质的磁性类型,还可以检测外界条件改变时磁性的转变;测定顺磁性物质的磁化率,有助于计算出每个分子中的非成对电子数,从而推测出该物质分子的配位场电子结构。
仪器与试剂
古埃磁天平(包括磁场,电光天平,励磁电源等);
CT5型高斯计一台;
软质玻璃样品管4支;
装样品工具(研钵、角匙、小漏斗、玻璃棒)一套。
(NH4)2SO4·FeSO4·6H2O (分析纯)
FeSO4·7H2O (分析纯)
K4Fe(CN)6·3H2O (分析纯)
1.2 实验步骤
1) 研细粉末样品
2) 测定(NH4)2SO4·FeSO4·6H2O的相关数据: 取一只空样品管,使励磁电流从小到大再从大到小,依次测量其在I=0、3A、4A、4A、3A、0时的视重质量,并重复一次。向该样品管中匀实的装入样品粉末,保证样品柱高度超过15cm并且记下高度值;仿照上述测空样品管的步骤,依次测六个电流值时的视重质量,并重复一次。
3) 测定FeSO4·7H2O和K4Fe(CN)6·3H2O的相关数据:另取一只空样品管,仿照测(NH4)2SO4·FeSO4·6H2O的步骤,将样品改为FeSO4·7H2O测定并记录有关数据。再换一只空样品管,测K4Fe(CN)6·3H2O。
1.3 注意事项
1)操作中电流调节要缓慢,并注意电流稳定后方可称量;
2)样品管底部要与磁极中心线齐平;
3)称量时样品管要处于两个磁极的中间;
4)样品的高度必须h≥15cm,而且准确记录下来;
5)样品要研细、填实。
3.结果与讨论
3.1 实验结果
FeSO4·7H2O 摩尔磁化率χM=3.00E-5 m3/mol ;未成对电子数n≈4 ;
K4Fe(CN)6·3H2O 摩尔磁化率χM=-6.809 E-7 m3/mol ;未成对电子数n≈0
3.2 结果讨论
1)配合物的空间结构
FeSO4·7H2O的结构式为 [Fe(II)(H2O)6] SO4·H2O,即中心原子Fe2+由周围的6个水分子配位,形成的是正八面体空间结构。
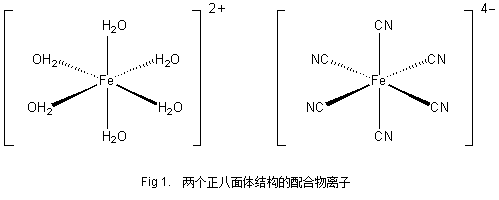 K4Fe(CN)6·3H2O的结构式为K4 [Fe(II)(CN)6]·3H2O,即中心原子Fe2+由周围的6个氰根离子配位,形成的也是正八面体空间结构。
K4Fe(CN)6·3H2O的结构式为K4 [Fe(II)(CN)6]·3H2O,即中心原子Fe2+由周围的6个氰根离子配位,形成的也是正八面体空间结构。
2)配位场的电子结构的讨论
ML6型配合物分子的配位场电子轨道依次是(a1g)(t1u)(eg)(t2g)(e*g)(t*1u)(a*1g) 。
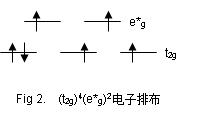 [Fe(II)(H2O)6]2+,其中心原子Fe2+提供6个3d电子,周围6个水分子配体共提供12个配位电子,6+12=18电子。又因为水分子是弱配体,故[Fe(II)(H2O)6]2+的配位场电子结构为(a1g)2(t1u)6(eg)4(t2g)4(e*g)2 。
[Fe(II)(H2O)6]2+,其中心原子Fe2+提供6个3d电子,周围6个水分子配体共提供12个配位电子,6+12=18电子。又因为水分子是弱配体,故[Fe(II)(H2O)6]2+的配位场电子结构为(a1g)2(t1u)6(eg)4(t2g)4(e*g)2 。
可见在 (t2g) 和 (e*g) 轨道上各有2个未成对电子,共有n=4 ;另外按照杂化轨道理论称之为sp3d2型配键。
 所以FeSO4·7H2O是弱场高自旋的电价配合物。
所以FeSO4·7H2O是弱场高自旋的电价配合物。
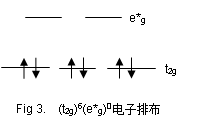
[Fe(II)(CN)6]4-,其中心原子Fe2+提供6个3d电子,周围6个氰根配体共提供12个配位电子,6+12=18电子。又因为氰根离子是强配体,故[Fe(II)(CN)6]4-的配位场结构与上述的不同,为(a1g)2(t1u)6(eg)4(t2g)6(e*g)0 。
可见在所有轨道上都没有未成对电子,n=0 ;另外按照杂化轨道理论称之为d2sp3型配键。
所以K4Fe(CN)6·3H2O是强场低自旋的共价配合物。
3)不同磁场强度H下样品的摩尔磁化率χM不同的原因
不同励磁电流I(因而不同磁场强度H)下测得的摩尔磁化率χM并不相同, 因为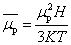 这一关系式是经典电磁理论的统计力学结果,它把磁矩取向视为可以连续变化的;但是基于量子力学理论,磁矩取向是量子化的而不能连续改变,上述
这一关系式是经典电磁理论的统计力学结果,它把磁矩取向视为可以连续变化的;但是基于量子力学理论,磁矩取向是量子化的而不能连续改变,上述 对
对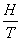 的线性关系只是在
的线性关系只是在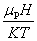 <<1条件下的一阶近似。磁场强度H足够大时,必须考虑
<<1条件下的一阶近似。磁场强度H足够大时,必须考虑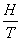 的高阶修正项如
的高阶修正项如 。所以
。所以 只是在
只是在 的一阶近似下表现为不随H改变的常数;当高阶修正项不能忽略时,摩尔磁化率χM表现为随磁场强度H(因而也随励磁电流I)改变的量。
的一阶近似下表现为不随H改变的常数;当高阶修正项不能忽略时,摩尔磁化率χM表现为随磁场强度H(因而也随励磁电流I)改变的量。
4)误差分析
①实验理论公式的推导中用到一些近似,例如忽略顺磁性物质逆磁磁化率的影响,忽略样品柱远离磁场一端的磁化率等。
②励磁电流不能每次都准确地定在同一位置,前文所述的3A、4A等值都只能保证大概在这个位置附近,因此实际上磁场强度H并非每次都是一致的。
③测量样品高度h的误差严重影响实验的精度,这从摩尔磁化率的计算公式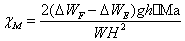 可以看出来。而由于最上面的那些样品粉末不能压紧压平,测量高度h的误差还是比较大的。
可以看出来。而由于最上面的那些样品粉末不能压紧压平,测量高度h的误差还是比较大的。
④装样不紧密也会带来较大误差,推导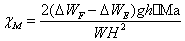 公式时用到了密度ρ,最后表现在高度h中。“装样不紧密”也就是说实际堆密度比理论密度小,这样高度h就会比理论值偏大,即使很准确地测量出高度h,它还是比理论值有一个正的绝对误差。
公式时用到了密度ρ,最后表现在高度h中。“装样不紧密”也就是说实际堆密度比理论密度小,这样高度h就会比理论值偏大,即使很准确地测量出高度h,它还是比理论值有一个正的绝对误差。
⑤装样品的试管在磁场(电流)变化时会有振动,尽管已经尽可能慢的改变电流,但微小振动仍然存在,即会在读取质量时产生误差
参考文献:
[1] 崔献英,柯燕雄,单绍纯.物理化学实验[M].中国科技大学出版社,2000: 29~32.
[2] 付献彩,沈文霞,姚天扬,侯文华.《物理化学》(第五版)上册[M].高等教育出版社,2005:277~280.
附件:实验数据处理
1. 数据记录
T:17.7
(NH4)2SO4·FeSO4·6H2O:
样品柱高度h1=15.30cm
Table 1
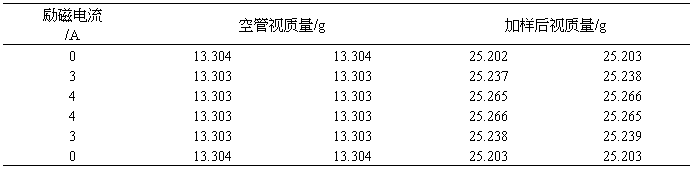
FeSO4·7H2O:
样品柱高度h2=15.20cm
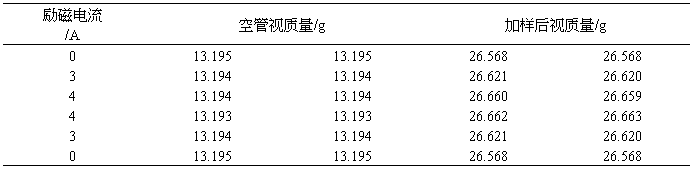
K4Fe(CN)6·3H2O:
样品柱高度h3=15.35cm
Table 3

2. 数据处理
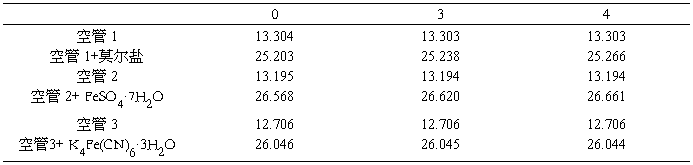
2.1 数据计算
Table 4
2.2由(NH4)2SO4·FeSO4·6H2O的数据计算磁场强度H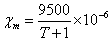 ,T=(17.9+17.5)/2=17.7℃=290.85K
,T=(17.9+17.5)/2=17.7℃=290.85K
χm=3.255E-5 cm3/g
由Table 1.的数据求得下表:
Table 5
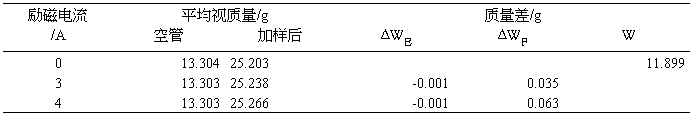
h=15.30cm,g=981,χm=3.255E-5 cm3/g,M=
∴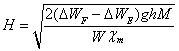 =3307.7 Gauss (I=3A),
=3307.7 Gauss (I=3A),
= 4410.3 Gauss (I=4A)。
2.3 由FeSO4·7H2O的数据计算摩尔磁化率χM和未成对电子数n
Table 6
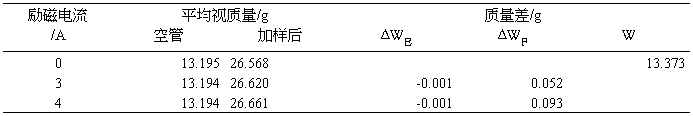
h=15.20cm, M=278.01
3A时: H=3307.7 Gauss,
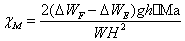 = 3.004E-5m3/g
= 3.004E-5m3/g
4A时:h= 4410.3 Gauss
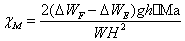 =2.996 E-5m3/g
=2.996 E-5m3/g
所以χm= 3.00E-5m3/g
由公式
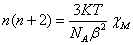 ,
,
T=290.85K,NA=6.022E23 mol-1,K=1.381E-16 erg/K,β=9.274E-21 erg/Gauss
解得:n=4
2.4由K4Fe(CN)6·3H2O的数据计算摩尔磁化率χM和未成对电子数n
Table 7
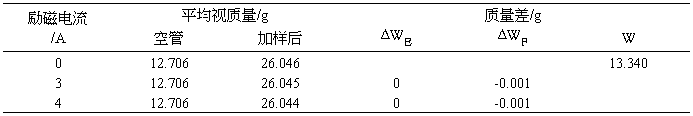
h=15.35cm, M=422.39
3A时:
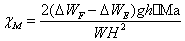 = -8.716 E-7m3/g
= -8.716 E-7m3/g
4A时:
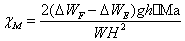 =-4.902 E-7 m3/g
=-4.902 E-7 m3/g
所以χm=6.809 E-7m3/g
由公式
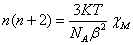 ,
,
T=290.85K,NA=6.022E23 mol-1,K=1.381E-16 erg/K,β=9.274E-21 erg/Gauss
解得:n=0
第二篇:大学物理化学实验报告-络合物的磁化率的测定

物理化学实验报告
院系 化学化工学院
班级 化学 061
学号 13
姓名 沈建明
实验名称 络合物的磁化率的测定
日期 2009.4.20 同组者姓名 史黄亮
室温 22.5℃ 气压 101.6 kPa
成绩
一、目的和要求
1、掌握古埃(Gouy)法磁天平测定物质磁化率的基本原理和实验方法;
2、通过对一些络合物的磁化率测定,推算其不成对电子数,判断这些分子的配键类型
二、基本原理
物质的磁性一般可分为三种: 顺磁性, 反磁性和铁磁性。
a .反磁性是指磁化方向和外磁场方向相反时所产生的磁效应。反磁物质的χD < 0(电子的拉摩进动产生一个与外磁场方向相反的诱导磁矩,导致物质具有反磁性)。
b. 顺磁性是指磁化方向和外磁场方向相同时所产生的磁效应,顺磁物质的 Xp > 0。(外磁场作用下,粒子如原子、分子、离子,中固有磁矩产生的磁效应)。
c. 铁磁性是指在低外磁场中就能达到饱和磁化,去掉外磁场时,磁性并不消失,呈现出滞后现象等一些特殊的磁效应。
d. 摩尔磁化率:
古埃法测定物质的摩尔磁化率( )的原理
通过测定物质在不均匀磁场中受到的力,求出物质的磁化率 。
把样品装于园形样品管中,悬于两磁极中间,一端位于磁极间磁场强度最大区域 H,而另一端位于磁场强度很弱的区域 H 0,则样品在沿样品管方向所受的力F可表示为:
其中:m为样品质量,H为磁场强度, 为沿样品管方向的磁场梯度。
本实验用摩尔氏盐(六水合硫酸亚铁铵)标定外磁场强度H。测定亚铁氰化钾和硫酸亚铁的摩尔磁化率,求金属离子的磁矩并考察电子配对状况。
三、仪器、试剂
MB-1A磁天平(包括电磁铁,电光天平,励磁电源) 1套
软质玻璃样品管 1只
角匙 1只
漏斗 1只
莫尔氏盐(NH4)2SO4·FeSO4·6H2O(分析纯)
FeSO4·7H2O(分析纯)
K4Fe(CN)6·3H2O(分析纯)
四、实验步骤
1. 磁场强度(H)的测定 :
用已知摩尔磁化率的莫尔氏盐标定某一固定励磁电流时的磁场强度(H).励磁电流变化0A→3A→3.5A→4A→3.5A→3A→0A,分别测定励磁电流在各值下的天平的读数(4A的值可以不读,持续2分钟左右,消磁),用同一仪器在同等条件下进行后续的测定。
具体操作如下:
(1)把样品管悬于磁场的中心位置,测定空管在加励磁电流前,后磁场中的重量。求出空管在加磁场前,后的重量变化管 ,重复测定三次读数,取平均值。
(2)把已经研细的莫尔氏盐通过小漏斗装入样品管,样品高度约为8m(此时样品另一端位于磁场强度H=0处)。读出样品的高度,要注意样品研磨细小,装样均匀不能有断层。测定莫尔氏盐在加励磁电流前,后磁场中的重量。求出在加磁场前后的重量变化样品+管,重复测定三次读数,取平均值。
2.样品的莫尔磁化率测定:
把测定过莫尔氏盐的试管擦洗干净,把待测样品
,分别装在样品管中,按着上述步骤(1),(2)分别测定在加磁场前,后的重量。求出重量的变化(管和样品+管),重复测定三次读数,取平均值。
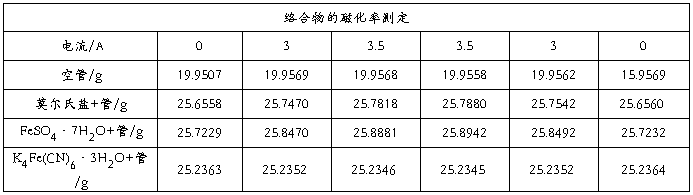
五、原始数据
T=22.5℃ h=8cm
MFeSO4·7H2O =278.02 g/mol
MK4Fe(CN)6·3H2O =422.39 g/mol
M莫尔氏盐 =392 g/mol
六、数据处理
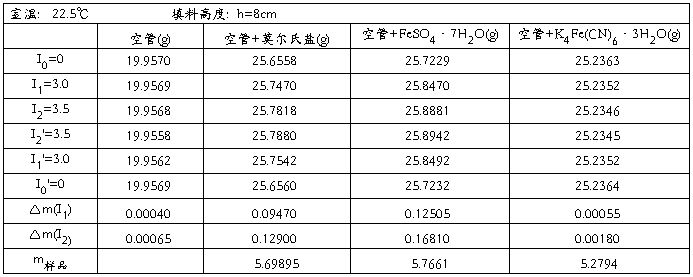
(一) 由莫尔氏盐质量磁化率和实验数据计算相应的励磁电流下的磁场强度值:
在实验温度(22.5℃=295.65K)下:
莫尔氏盐的标准χm =9500/(T+1)*4π*10-9
=9500/(295.65+1)*4π*10-9
=4.04*10-7 m3·kg-1
所以莫尔氏盐的摩尔磁化率χM = M莫尔氏盐*χm
=392 g/mol * 4.04*10-7 m3·kg-1
=1.58 ×10-7 m3·mol-1
根据公式
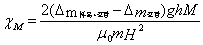
求不同励磁电流下的磁场强度H:
I=3.0A时:
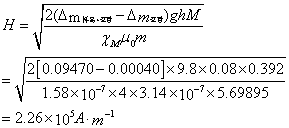
同理可得,I=3.5A时:
H=2.64×105 A·m-1
(二) 计算FeSO4·7H2O和K4Fe(CN)6·3H2O的χm 再计算其μm和未成对电子数n

现以FeSO4·7H2O为例做计算示例:
根据公式: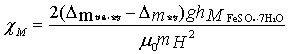
求出FeSO4·7H2O在两个不同的励磁电流下的χM 并取平均值,
得,
 m³·mol-1
m³·mol-1
再根据公式: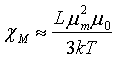
其中 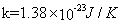 ;
;
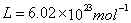 ;
;
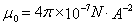
解得,

最后利用关系式: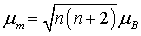
解得,
n=4.33≈4
(三) 根据未成对电子数,讨论FeSO4·7H2O和K4Fe(CN)6·3H2O中Fe2+的最外层电子结构及由此构成的配键类型
FeSO4·7H2O中Fe2+外层电子组态:
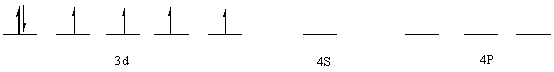
可知:FeSO4·7H2O中配价键为电价配键。
K4Fe(CN)6·3H2O中Fe2+外层电子组态:
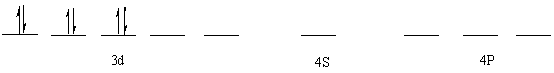
可知:K4Fe(CN)6·3H2O中配价键为共价配键。
七、思考题
1、不同的励磁电流测得的样品摩尔磁化率是否相同?如果测量结果不同应如何解释?
答:χM一样。因为物质的摩尔磁化率是物质的一种宏观性质,而与外界条件无关,不会因为励磁电流的改变而改变。
本实验在处理数据时,求了不同励磁电流下的χM ,是为了更精确,求得的为两次测量的平均值。
2、引起误差的原因?
答:1.没有把样品管底与磁极中心线平行,因磁场不均匀,测得的Δm样+管与Δm有偏差;
2.测空管时,管内残留有少量原先无法除去的杂质;
3.样品没有研磨细小,装样不均匀或有断层;
4.环境的扰动(因为本组实验是靠门口的,进出人员带来的环境的扰动是不可避免的);
5.仪器本身存在误差。
八、实验总结
本实验的操作部分其实并没有特别困难之处,关键在与环境及条件的控制,尽量避免系统的扰动,当然,也由于无可避免的误差的存在会给计算结果产生一定的影响。
本实验难就难在数据的处理比较困难,因为其原理不易懂,造成推导得到的公式不明白,而在转换、交叉计算时产生混淆。还有在计算过程中单位的统一非常关键(起初我也有单位原因的错误)。
最后,通过计算得到的结果与实际接近,实验还算成功。但还有一点不明白,课本第386页上,K4Fe(CN)6·3H2O的磁化率为什么是负值?
