主链由长到短,支链由整到散,位置由心到边,排布由对到邻到间。
高二化学选修5有机化学知识点归纳整理(A4) ⑵ 具有官能团的化合物如烯烃、炔烃、醇、酮等,它们具有碳链异构、官能团位置异构、
异类异构,书写按顺序考虑。一般情况是碳链异构→官能团位置异构→异类异构。 一、同系物
⑶ 芳香族化合物:二元取代物的取代基在苯环上的相对位置具有邻、间、对三种。 结构相似,在分子组成上相差一个或若干个CH2原子团的物质物质。
3、判断同分异构体的常见方法: 同系物的判断要点:
1、通式相同,但通式相同不一定是同系物。
2、组成元素种类必须相同
3、结构相似指具有相似的原子连接方式,相同的官能团类别和数目。结构相似不一定完全
相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链仍为同系物。
4、在分子组成上必须相差一个或几个CH2原子团,但通式相同组成上相差一个或几个CH2
原子团不一定是同系物,如CH3CH2Br和CH3CH2CH2Cl都是卤代烃,且组成相差一个CH2原
子团,但不是同系物。
5、同分异构体之间不是同系物。
二、同分异构体
化合物具有相同的分子式,但具有不同结构的现象叫做同分异构现象。
具有同分异构现象的化合物互称同分异构体。
1、同分异构体的种类:
⑴ 碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。如C5H12有三种同
分异构体,即正戊烷、异戊烷和新戊烷。
⑵ 位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。如1—丁烯与2—
丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑶ 异类异构:指官能团不同而造成的异构,也叫官能团异构。如1—丁炔与1,3—丁二烯、
丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦
芽糖等。
⑷ 其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段
的信息题中屡有涉及。
各类有机物异构体情况:
⑴ CnH2n+2:只能是烷烃,而且只有碳链异构。如CH3(CH2)3CH3、CH3CH(CH3)CH2CH3、C(CH3)4 ⑵ CnH2n:单烯烃、环烷烃。如CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2、2 、2
—2 ⑶ CnH2
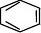
n-2:炔烃、二烯烃。如:CH≡CCH2CH3、CH3C≡CCH3、CH2=CHCH=CH2
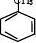
CH2—CH —CH3 2—2 ⑷ C
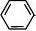
nH2n-6:芳香烃(苯及其同系物)。如:CHCH3CH3 CH3 3 、、CH3
⑸ CnH2n+2O:饱和脂肪醇、醚。如:CH3CH2CH2OH、CH3CH(OH)CH3、CH3OCH2CH3
⑹ CnH2nO:醛、酮、环醚、环醇、烯基醇。如:CH3CH2CHO、CH3COCH3、CH2=CHCH2OH、
、 2—2 、 2 CH2—CH —CH3 ⑺ C2 CH2—CH —OH nH2nO2:羧酸、酯、羟醛、羟基酮。如:CH3CH2COOH、CH3COOCH3、HCOOCH2CH3、HOCH2CH2CHO、CH3CH(OH)CHO、CH3COCH2OH ⑻ CnH2n+1NO2:硝基烷、氨基酸。如:CH3CH2NO2、H2NCH2COOH ⑼ Cn(H2O)m:糖类。如: C6H12O6:CH2OH(CHOH)4CHO,CH2OH(CHOH)3COCH2OH C12H22O11:蔗糖、麦芽糖。
2、同分异构体的书写规律: ⑴ 烷烃(只可能存在碳链异构)的书写规律: - 1 -
⑴ 记忆法: ① 碳原子数目1~5的烷烃异构体数目:甲烷、乙烷和丙烷均无异构体,丁烷有两种异构体,戊烷有三种异构体。 ② 碳原子数目1~4的一价烷基:甲基一种(—CH3),乙基一种(—CH2CH3)、丙基两种 (—CH2CH2CH3、—CH(CH3)2)、 丁基四种(—CH2CH2CH2CH3、 CH32CH3 、—CH2CH(CH3)2、—C(CH3)3) ③ 一价苯基一种、二价苯基三种(邻、间、对三种)。 ⑵ 基团连接法:将有机物看成由基团连接而成,由基团的异构数目可推断有机物的异构体数目。 如:丁基有四种,丁醇(看作丁基与羟基连接而成)也有四种,戊醛、戊酸(分别看作丁基跟 醛基、羧基连接而成)也分别有四种。 ⑶ 等同转换法:将有机物分子中的不同原子或基团进行等同转换。 如:乙烷分子中共有6个H原子,若有一个H原子被Cl原子取代所得一氯乙烷只有一种结构,那么五氯乙烷有多少种?假设把五氯乙烷分子中的Cl原子转换为H原子,而H原子转换为Cl原子,其情况跟一氯乙烷完全相同,故五氯乙烷也有一种结构。同样,二氯乙烷有两种结构,四氯乙烷也有两种结构。 ⑷ 等效氢法:等效氢指在有机物分子中处于相同位置的氢原子。等效氢任一原子若被相同取代基取代所得产物都属于同一物质。其判断方法有: ① 同一碳原子上连接的氢原子等效。 ② 同一碳原子上连接的—CH3中氢原子等效。如:新戊烷中的四个甲基连接于同一个碳原子上,故新戊烷分子中的12个氢原子等效。 3 3 ③ 同一分子中处于镜面对称(或轴对称)位置的氢原子等效。如:CH3——CCH3 分 子中的18个氢原子等效。 三、有机物的系统命名法 CH3 CH3 1、烷烃的系统命名法 ⑴ 定主链:就长不就短。选择分子中最长碳链作主链(烷烃的名称由主链的碳原子数决定)
⑵ 找支链:就近不就远。从离取代基最近的一端编号。
⑶ 命名: ① 就多不就少。若有两条碳链等长,以含取代基多的为主链。 ② 就简不就繁。若在离两端等距离的位置同时出现不同的取代基时,简单的取代基优先编号(若为相同的取代基,则从哪端编号能使取代基位置编号之和最小,就从哪一端编起)。
③ 先写取代基名称,后写烷烃的名称;取代基的排列顺序从简单到复杂;相同的取代基合并以汉字数字标明数目;取代基的位置以主链碳原子的阿拉伯数字编号标明写在表示取代基数目的汉字之前,位置编号之间以“,”相隔,阿拉伯数字与汉字之间以
“—”相连。
⑷ 烷烃命名书写的格式: 简单的取代基 复杂的取代基 主链碳数命名
2、含有官能团的化合物的命名 ⑴ 定母体:根据化合物分子中的官能团确定母体。如:含碳碳双键的化合物,以烯为母体,
化合物的最后名称为“某烯”;含醇羟基、醛基、羧基的化合物分别以醇、醛、酸为母体;苯的同系物以苯为母体命名。
⑵ 定主链:以含有尽可能多官能团的最长碳链为主链。 ⑶ 命名:官能团编号最小化。其他规则与烷烃相似。 如: CH3—2
3
CH3——CCHO
CH3—C—CH3
CH3 CH3
OH CH3
⑸ -1价的I(氢碘酸及碘化物)变色 ⑹ NaOH等强碱、Na2CO3和AgNO3等盐 Br2 + H2O = HBr + HBrO 2HBr + Na2CO3 = 2NaBr + CO2↑+ H2O HBrO + Na2CO3 = NaBrO + NaHCO3
七、能萃取溴而使溴水褪色的物质
上层变无色的(ρ>1):卤代烃(CCl4、氯仿、溴苯等)、CS2等; 下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态
饱和烃(如己烷
八、能使酸性高锰酸钾溶液褪色的物质
1、有机物:
⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯
酯、油酸、油酸酯等)⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 醇类物质(乙醇等)、酚类物质。
⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)⑹ 天然橡胶(聚
异戊二烯) ⑺ 苯的同系物 2、无机物:
⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物)
⑵ + 2价的Fe(亚铁盐及氢氧化亚铁)⑶ -2价的S(硫化氢及硫化物) ⑷ + 4价的S(二氧化硫、亚硫酸及亚硫酸盐)⑸ 双氧水(H2O2)
叫作:2,3—二甲基—2—丁醇 叫作:2,3—二甲基—2—乙基丁醛 四、有机物的物理性质 1、状态: 固态:饱和高级脂肪酸、脂肪、葡萄糖、果糖、蔗糖、麦芽糖、淀粉、维生素、醋酸(16.6℃
以下);
4以下的烷、烯、炔烃、甲醛、一氯甲烷、新戊烷; 油状:乙酸乙酯、油酸;
粘稠状:石油、乙二醇、丙三醇。
2、气味:
无味:甲烷、乙炔(常因混有PH3、H2S和AsH3而带有臭味);
稍有气味:乙烯;特殊气味:甲醛、乙醛、甲酸和乙酸;香味:乙醇、低级酯; 3、颜色:白色:葡萄糖、多糖 黑色或深棕色:石油 4、密度:
比水轻:苯、液态烃、一氯代烃、乙醇、乙醛、低级酯、汽油; 比水重:溴苯、乙二醇、丙三醇、CCl4。 5、挥发性:乙醇、乙醛、乙酸。 6、水溶性:
不溶:高级脂肪酸、酯、溴苯、甲烷、乙烯、苯及同系物、石油、CCl4; 易溶:甲醛、乙酸、乙二醇;与水混溶:乙醇、乙醛、甲酸、丙三醇。
五、最简式相同的有机物
1、CH:C2H2、C6H6(苯、棱晶烷、盆烯)、C8H8(立方烷、苯乙烯); 2、CH2:烯烃和环烷烃;3、CH2O:甲醛、乙酸、甲酸甲酯、葡萄糖;
4、CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数的饱和一元羧酸或酯;如乙醛(C2H4O)与丁酸及异构体(C4H8O2)5、炔烃(或二烯烃)与三倍于其碳原子数的苯及苯的同系物。如:丙炔(C3H4)与丙苯(C9H12)
六、能与溴水发生化学反应而使溴水褪色或变色的物质
1、有机物:
⑴ 不饱和烃(烯烃、炔烃、二烯烃等)
⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)
⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)、酚类。 ⑸ 天然橡胶(聚异戊二烯) 2、无机物:
⑴ -2价的S(硫化氢及硫化物)⑵ + 4价的S(二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe 6FeSO4 + 3Br2 = 2Fe2(SO4)3 + 2FeBr36FeCl2 + 3Br2 = 4FeCl3 + 2FeBr3 变色 2FeI2 + 3Br2 = 2FeBr3 + 2I2
△
⑷ Zn、Mg等单质 如 Mg + Br2 === MgBr2 (其中亦有Mg与H+、Mg与HBrO的反应)
有机化学知识点归纳(二)
一、有机物的结构与性质
1、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。
原子:—X
官能原子团(基):—OH、—CHO(醛基)、—COOH(羧基)、C6H5—
团 、 —C≡C—
2、常见的各类有机物的官能团,结构特点及主要化学性质 (1)烷烃
A) 官能团:无 ; 通式:CnH2n+2; 代表物:CH4
B) 结构特点:键角为109°28′,空间正四面体分子。烷烃分子中的每个C原子的四个价键也都如此。
C) 化学性质:①取代反应(与卤素单质、在光照条件下)
光 光
CH3Cl + Cl2CH2Cl2 + HCl CH4 + Cl2CH3Cl + HCl
点燃 ②燃烧 CH4 + 2O2CO2 + 2H2O 高温 ③热裂解 CH4C + 2H2
隔绝空气
(2)烯烃: A) ; 通式:CnH2n(n≥2); 代表物:H2C=CH2 B) 结构特点:键角为120°,双键碳原子与其所连接的四个原子共平面。
- 2 -
C) 化学性质:
①加成反应(与X2、H2、HX、H2O等)
CCl4
CH2=CH2 + Br2CH2=CH2 + HX
催化剂
CH2=CH2 + H2O
加热、加压
催化剂
BrCH2CH2Br CH3CH2X CH3CH2OH
②加聚反应(与自身、其他烯烃)
催化剂
nCH2=CH2CH2—CH2
③燃烧
点燃 CH2=CH2 + 3O22CO2 + 2H2O
(3)炔烃:
A) 官能团:—C≡C— ; 通式:CnH2n—2(n≥2); 代表物:HC≡CH B) 结构特点:碳碳叁键与单键间的键角为180°。
两个叁键碳原子与其所连接的两个原子在同一条直线上。
(4)苯及苯的同系物:
A) 通式:CnH2n—6(n≥6); 代表物:
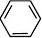
B)结构特点:苯分子中键角为120°,平面正六边形结构,6个C
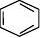
原子和6个H原子共平面。 C)化学性质:
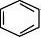
①取代反应(与液溴、HNO3、H2SO4等) Fe或FeBr3
Br + HBr↑ + Br2
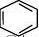
浓H2SO4 NO2 + H2O + HNO3 60℃ H2、Cl2
等)
Ni
+ 3H2△
(5)醇类:
A) 官能团:—OH(醇羟基);
代表物:
CH3CH2OH、HOCH2CH2OH
B) 结构特点:羟基取代链烃分子(或脂环烃分子、苯环侧链上)的氢原子而得到的产物。
结构与相应的烃类似。
C) 化学性质:
①羟基氢原子被活泼金属置换的反应
HOCH2CH2OH + 2NaNaOCH2CH2ONa + H2↑ 2CH3CH2OH + 2Na2CH3CH2ONa + H2↑
△
②跟氢卤酸的反应
CH3CH2OH + HBrCH3CH2Br + H2O
③催化氧化(α—H)
Cu或Ag
Cu或Ag
OHC—CHO+ 2H2O △ 2CH3CH2OH + O22CH3CHO + 2H2O HOCH3CH2OH + O2
△
3CHCH3 + O2Cu或Ag 2CH3CCH3 + 2H2O 2CH
△
(与官能团直接相连的碳原子称为α碳原子,与α碳原子相邻的碳原子称为β碳原子,依次类推。与α碳原子、β碳原子、??相连的氢原子分别称为α氢原子、β氢原子、??)
浓 H2SO4④酯化反应(跟羧酸或含氧无机酸): CH3COOH + CH3CH23COOCH2CH3 + H2O
△
(6)醛酮
— 或—CO—) ;代表物:CH3CHO、HCHO 、 CH3—C—CH3 —H 或—CHO)、—A) 官能团:— ( (
B) 结构特点:醛基或羰基碳原子伸出的各键所成键角为120°,
该碳原子跟其相连接的各原子在同一平面上。
C) 化学性质:
①加成反应(加氢、氢化或还原反应)
催化剂 催化剂
CH3—CCH3 CH3CHO + HCH3CH2OH 2 + H2CH3CHCH3 △ △
②氧化反应(醛的还原性)
点燃 催化剂
2CH3CHO + 5O24CO2 + 4H2O 2CH3CHO + O22CH3COOH △
CH3COONH4 + 2Ag↓ + 3NH3 + H2O (银镜反应) CH3CHO + 2[Ag(NH3)2OH]
△
CH3CHO + 2Cu(OH)2CH3COOH + Cu2O↓ + H2O (费林反应)
(7)羧酸
——OH 或—COOH); 代表物:CHCOOH A) 官能团: (3
B) 结构特点:羧基上碳原子伸出的三个键所成键角为120°,
该碳原子跟其相连接的各原子在同一平面上。
C) 化学性质:
①具有无机酸的通性
2CH3COOH + Na2CO32CH3COONa + H2O +CO2↑
②酯化反应
- 3 -
浓 H2SO4
3COOCH2CH3 + H2O (酸脱羟基,醇脱氢) CH3COOH + CH3CH2
△
O
(8)酯类
—O—R
A) 官能团: (或—COOR)(R为烃基); 代表物: CH3COOCH2CH3
B) 结构特点:成键情况与羧基碳原子类似
C) 化学性质:
水解反应(酸性或碱性条件下)
稀H2SO4
CH3COOCH2CH3 + H23COOH + CH3CH2OH
△
△
CH3COOCH2CH3 + NaOHCH3COONa + CH3CH2OH
CH2COOH (9)氨基酸
A) 官能团:—NH2、—COOH ; 代表物:2
B) 化学性质: 因为同时具有碱性基团—NH2和酸性基团—COOH,所以氨基酸具有酸性和碱性。
3、常见糖类、蛋白质和油脂的结构和性质 (1)单糖
A) 代表物:葡萄糖、果糖(C6H12O6)
B) 结构特点:葡萄糖为多羟基醛、果糖为多羟基酮 C) 化学性质:
①葡萄糖类似醛类,能发生银镜反应、费林反应等; ②具有多元醇的化学性质。 (2)二糖
A) 代表物:蔗糖、麦芽糖(C12H22O11)
B) 结构特点:蔗糖含有一个葡萄糖单元和一个果糖单元,没有醛基;
麦芽糖含有两个葡萄糖单元,有醛基。
C) 化学性质:①蔗糖没有还原性,麦芽糖有还原性。②水解反应 +
H
(3)多糖
C12H22O11 + H2O C6H12O6 + C6H12O6
蔗糖 葡萄果糖
+
H 糖
C12H22O11 + H2O 2C6H12O6
麦芽糖 葡萄糖
A) 代表物:淀粉、纤维素 [ (C6H10O5)n ] B) 结构特点:由多个葡萄糖单元构成的天然高分子化合物。淀粉所含的葡萄糖单元比纤维素的少。
C) 化学性质:
H2SO4
①淀粉遇碘变蓝。
△ nC6H12O6 ②水解反应(最终产物均为葡萄糖) (C6H10O5)n + nH2O
淀粉 葡萄糖
(4)蛋白质
A) 结构特点:由多种不同的氨基酸缩聚而成的高分子化合物。结构中含有羧基和氨基。 B) 化学性质:
①两性:分子中存在氨基和羧基,所以具有两性。
②盐析:蛋白质溶液具有胶体的性质,加入铵盐或轻金属盐浓溶液能发生盐析。
盐析是可逆的,采用多次盐析可分离和提纯蛋白质(胶体的性质)
③变性:蛋白质在热、酸、碱、重金属盐、酒精、甲醛、紫外线等作用下会发生性质改变而凝结,称为变性。变性是不可逆的,高温消毒、灭菌、重金属盐中毒都属变性。 ④颜色反应:蛋白质遇到浓硝酸时呈黄色。 ⑤灼烧产生烧焦羽毛气味。
⑥在酸、碱或酶的作用下水解最终生成多种α—氨基酸。
(5)油脂
A)组成:油脂是高级脂肪酸和甘油生成的酯。
常温下呈液态的称为油,呈固态的称为脂,统称油脂。 天然油脂属于混合物,不属于高分子化合物。 C17H35COOCH2
C17H33COOCH2 B) 代表物:
C17H35COOCH 油酸甘油酯:硬脂酸甘油酯: C17H33COOCH
C17H35COOCH2
CHCOOCH 17332
R1—COOCH2
R2—C) 结构特点:油脂属于酯类。天然油脂多为混甘油酯。分子结构为:
R3—COOCH2
R表示饱和或不饱和链烃基。R1、R2、R3可相同也可不同,相同时为单甘油酯,不同时为混甘油酯。D) 化学性质:
①氢化:油脂分子中不饱和烃基上加氢。如油酸甘油酯氢化可得到硬脂酸甘油酯。 ②水解:类似酯类水解。酸性水解可用于制取高级脂肪酸和甘油。
碱性水解又叫作皂化反应(生成高级脂肪酸钠), 皂化后通过盐析(加入食盐)使肥皂析出(上层)。
5、重要有机化学反应的反应机理
(1)醇的催化氧化反应中,若醇没有α—H,则不能进行催化氧化反应。 O
浓H2SO4 (2)酯化反应 CH3— —CH2CH33COOCH2CH3 + H2O
△
说明:酸脱羟基而醇脱羟基上的氢,生成水,同时剩余部分结合生成酯。 二、有机化学反应类型 1、取代反应
指有机物分子中的某些原子或原子团被其他原子或原子团取代的反应。 常见的取代反应:
- 4 -
⑴烃(主要是烷烃和芳香烃)的卤代反应; 三、有机化学计算
⑵芳香烃的硝化反应; 1、有机物化学式的确定
⑶醇与氢卤酸的反应、醇的羟基氢原子被置换的反应; (1)确定有机物的式量的方法
⑷酯类(包括油脂)的水解反应; ①根据标准状况下气体的密度ρ,求算该气体的式量:M = 22.4ρ(标准状况)
⑸酸酐、糖类、蛋白质的水解反应。 ②根据气体A对气体B的相对密度D,求算气体A的式量:MA = DMB
2、加成反应 ③求混合物的平均式量:M = m(混总)/n(混总)
指试剂与不饱和化合物分子结合使不饱和化合物的不饱和程度降低或生成饱和化合物的反④根据化学反应方程式计算烃的式量。
应。 ⑤应用原子个数较少的元素的质量分数,在假设它们的个数为1、2、3时,求出式量。
常见的加成反应:⑴烯烃、炔烃、芳香族化合物、醛、酮等物质都能与氢气发生加成反应(也(2)确定化学式的方法
叫加氢反应、氢化或还原反应);⑵烯烃、炔烃、芳香族化合物与卤素的加成反应;⑶烯烃、炔①根据式量和最简式确定有机物的分子式。
烃与水、卤化氢等的加成反应。 ②根据式量,计算一个分子中各元素的原子个数,确定有机物的分子式。
3、聚合反应 ③当能够确定有机物的类别时。可以根据有机物的通式,求算n值,确定分子式。
指由相对分子质量小的小分子互相结合成相对分子质量大的高分子的反应。参加聚合反应的④根据混合物的平均式量,推算混合物中有机物的分子式。
小分子叫作单体,聚合后生成的大分子叫作聚合物。 (3)确定有机物化学式的一般途径
常见的聚合反应:
加聚反应:指由不饱和的相对分子质量小的小分子结合成相对分子质量大的高分子的反应。
催化剂
nCH2=CH2 CH2—CH2
较常见的加聚反应:
①单烯烃的加聚反应
在方程式中,—CH2—CH2—叫作链节,中叫作聚合度,CH2=CH2叫作单体, CH2—CH2。 CH2—CH2叫作加聚物(或高聚物)
CH CH 33(4)有关烃的混合物计算的几条规律 催化剂 ①若平均式量小于26,则一定有CH4 ②二烯烃的加聚反应: CH2——CH2 nCH2=C—CH=CH2 ②平均分子组成中,l < n(C) < 2,则一定有CH4。
③平均分子组成中,2 < n(H) < 4,则一定有C2H2。 4、氧化和还原反应
2、有机物燃烧规律及其运用 (1)氧化反应:有机物分子中加氧或去氢的反应均为氧化反应。
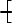
mm点燃CnHm?(n?)O2?????nCO2?H2O常见的氧化反应: R 42① 有机物使酸性高锰酸钾溶液褪色的反应。如:R—CH=CH—
R′、R—C≡C—Rmxm点燃(具有α—H)、—OH、R—CHO能使酸性高锰酸钾溶液褪色。 CnHmOx?(n??)O2?????nCO2?H2O 422 Cu或Ag ②醇的催化氧化(脱氢)反应: 2R——R′+ O22R—C—R′+ 2H2O (1)物质的量一定的有机物燃烧 △ OH 规律一:等物质的量的烃CnHm和Cn?mH5m,完全燃烧耗氧量相同。 Cu或Ag mm5m醛的氧化反应 ?(n?m)?(?m)?(n?m)?2RCH2OH + O22RCHO + 2H2O [n?] 444△
催化剂 规律二:等物质的量的不同有机物CnHm、CnHm(CO2)x、CnHm(H2O)x、2RCHO + O2RCOOH 2 CnHm(CO2)x(H2O)y(其中变量x、y为正整数),完全燃烧耗氧量相同。
③醛的银镜反应、 或者说,一定物质的量的由不同有机物CnHm、CnHm(CO2)x、费林反应(凡是分子中含有醛基或相当于醛基的结构,都可以发生此类反应)
(2)还原反应:有机物分子中去氧或加氢的反应均为还原反应。 CnHm(H2O)x、CnHm(CO2)x(H2O)y(其中变量x、y为正整数)组成的混合物,无 论以何种比例混合,完全燃烧耗氧量相同,且等于同物质的量的任一组分的耗氧量。 - 5 -
符合上述组成的物质常见的有:
①相同碳原子数的单烯烃与饱和一元醇、炔烃与饱和一元醛。其组成分别为
五、其他
即
最简式相同的有机物
(1)CH:C2H2、C4H4(乙烯基乙炔)、C6H6(苯、棱晶烷、盆烯)、C8H8(立方烷、苯乙烯) (2)CH2:烯烃和环烯烃
(3)CH2O:甲醛、乙酸、甲酸甲酯、葡萄糖
(4)CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数的饱和一元羧酸或酯。如:乙醛(C2H4O)与丁酸及异构体(C4H8O2)
(5)炔烃(或二烯烃)与三倍于其碳原子数的苯及苯的同系物。如丙炔(C3H4)与丙苯(C9H12)
CnH2n与CnH2n?2OCnH2n?2(H2O)。
即
CnH2n(H2O)
;
CnH2n?2
与
CnH2nO
②相同碳原子数的饱和一元羧酸或酯与饱和三元醇。
CnH2nO2即Cn?1H2n(CO2)、CnH2n?2O3即Cn?1H2n(CO2)(H2O)。
③相同氢原子数的烷烃与饱和一元羧酸或酯
CnH2n?2与Cn?1H2n?2O2即CnH2n?2(CO2)
规律三:若等物质的量的不同有机物完全燃烧时生成的H2O的量相同,则氢原子数相同,符合通式CnHm(CO2)x(其中变量x为正整数);若等物质的量的不同有机物完全燃烧时生成的CO2的量相同,则碳原子数相同,符合通式CnHm(H2O)x(其中变量x为正整数)。
(2)质量一定的有机物燃烧
规律一:从C+O2=CO2、6H2+3O2=6H2O可知等质量的碳、氢燃烧,氢耗氧量是碳的3倍。
可将CnHm→CHm/n,从而判断%m(H)或%m(C)。
推知:质量相同的烃(CnHm),m/n越大,则生成的CO2越少,生成的H2O越多,耗氧量越多。
规律二:质量相同的下列两种有机物CnHmOq与CnHm?16xOq?x完全燃烧生成CO2
物质的量相同;质量相同的下列两种有机物CnHmOq与Cn?xHmOq?0.75x,燃烧生成H2O物质的量相同。
规律三:等质量的具有相同最简式的有机物完全燃烧时,耗氧量相同,生成的CO2和H2O的量也相同。或者说,最简式相同的有机物无论以何种比例混合,只要总质量相同,耗氧量及生成的CO2和H2O的量均相同。
(3)由烃燃烧前后气体的体积差推断烃的组成
当温度在100℃以上时,气态烃完全燃烧的化学方程式为:
mm点燃
CnHm(g)?(n?)O2?????nCO2?H2O(g)
42
①△V > 0,m/4 > 1,m > 4。分子式中H原子数大于4的气态烃都符合。
②△V = 0,m/4 = 1,m = 4。、CH4,C2H4,C3H4,C4H4。 ③△V < 0,m/4 < 1,m < 4。只有C2H2符合。
(4)根据含氧烃的衍生物完全燃烧消耗O2的物质的量与生成CO2的物质的量之比,可推导有机物的可能结构
①若耗氧量与生成的CO2的物质的量相等时,有机物可表示为Cn(H2O)m ②若耗氧量大于生成的CO2的物质的量时,有机物可表示为(CxHy)n(H2O)m ③若耗氧量小于生成的CO2的物质的量时,有机物可表示为(CxOy)n(H2O)m (以上x、y、m、n均为正整数)
- 6 -
