############
毕业实习报告
实习地点 ######
实习时间 ####--####
系 部 ######
姓 名 #####
班级学号 #######
指导老师 ######
###年 ## 月## 日
实 习 报 告
实习时间: 20##年2月10日 到20##年2月20日
实习地点:########
实习任务:在#########做相关药物的鉴别检查和分析工作
一·实习目的:
(1) 熟悉药品生产工艺流程;
(2)学习各车间物料流程,加强GMP知识和安全知识的学习,把理论与实践相结合;
(3)了解各部门日常工作,亲自体验,并自我总结;
(4) 了解药厂厂区布局,车间布局,熟悉相关原则;
(5)体验上班族生活。丰富专业知识,积累工作经验,为以后走上工作岗位打基础;
(6)找到自身不足之处,早日弥补,增强自己适应社会能力;
(7)培养了我们与其他同学的团队合作、共同探讨、共同前进的精神。
(8)提高沟通及人际关系处理能力;
二·实习单位及岗位介绍
1、实习单位介绍
山西渊源药业有限公司是1999年在原“山西省朔州制药厂(国营)的基础上,经过资产重组,改制而成的股份制企业。公司地处山西省北部雁门关脚下。占地面积26400余平方米。拥有“乳酸菌素”原料药及固体口服制剂等两个生产车间,具有年产“乳酸 菌素”原料药100吨,片剂8亿片,胶囊剂200亿粒,散剂2亿袋的生产能力。公司注册资金460万元,现有固定资产2400万元。员工总数300人,,其中各类专业技术人员60人,分布在各管理一线的重要位置上。经国家批准注册的产品,除“乳酸菌素”原料药,“乳酸菌素”片、“乳酸菌 素”散外,另有其它口服制剂品种12个。主要有:抗感冒12个。主要有:抗感冒药、解热镇痛药、喹诺酮类抗感染药、头孢菌素抗生素、维生素及镇咳药等。公司生产的“乳酸菌素”片(商品名“舒畅宁”片)、“小儿乳酸菌素片”(商品名“小儿舒畅宁”片),是以新鲜牛奶为起始原料,经乳酸菌素发酵而成的生物药品。本品除可以治疗腹泻、便泌、消化不良等临床症状外,同时具有调整肠道菌群理稀、增加肠道营养以及通过加快体内粪毒素的排泻而延缓衰老等保健功能。“舒畅宁”、“小儿舒畅宁”,以其确切的疗效,优良的品质受到了广大消费者的好评,产品销至全国二十个省、市,其市场占有率已达到40%以上。 公司规章制度完善,纪律严明,企业认清了现在的形势:我国目前中小制药企业大部分缺乏明确的发展战略,有的企业忙于低头拉车,无暇抬头看路;有的企业并不了解战略的重要价值;有的企业有战略目标而缺乏有效的实施路径;有的企业十年前的战略规划几乎未做适时的调整,凡此种种,不一而足。在激烈竞争的市场环境中,其企业经营业绩可想而知。现代企业竞争,已不仅仅是产品的竞争,早已扩展为人才的竞争、品牌的竞争、模式的竞争、产业链的竞争和企业发展战略的竞争。制药行业是为人类健康服务的朝阳产业,制药企业肩负着崇高的使命和重任,既面临行业发展的大好时机,也面对企业竞争的严峻现状。策略领先、行动制胜,制定好的战略目标和战略规划,才能在同行中崭露头角,跟随时代发展潮流,在与时俱进中掌握发展核心,走进行业前头,蓬勃发展。
2、实习岗位介绍
我的实习岗位是做相关药物的成分粗略分析,相关成分的鉴别检查工作,同时做一些保持环境清洁的工作。具体如下:
1.负责公司相关物料、产品的卫生学检验和验证工作,做好检验记录,按检验周期出检验结果。
2.负责生测室部分菌种的保管、复壮及鉴定,保证检验所用菌种符合规定,并做好相应记录。
3.负责生测室的消毒及清洁工作,确保生测室环境达到万级洁净要求。
4.做好培养基的灵敏度试验,按规定进行阳性对照,确保检验结果准确。
5.按设备的操作规程进行消毒、灭菌和检验操作,确保人员及设备安全。
6.按规定处理实验废弃物。
三·实习安排
2013.1.7--------2013.1.10
查阅文献,听报告,了解了实习的主要内容和总体任务;听该公司相关负责人的安排,确定了我的岗位和职责;设计出我所做的实验,准备好我所需要的药品仪器等。
2013.1.11 休息
2013.1.12--------2013.1.16
根据我的实验计划进行了实验,并做了相应的实验记录。
2013.1.17 休息、整理实验记录
四·实习内容及过程
我实习的内容就是分析,检测与整理,过程为:查阅文献 → 设计自己的方法和实验→ 进行实验 → 整理在实验中反馈的信息和现象 → 在进行实验方案的调整 → 进行实验 → 得出结论。
部分操作项目如下:
(1)崩解时限的检查(崩解时限法)
1. 简述
1.1 本法(中国药典20##年版二部附录XA)适用于片剂(包括口服普通片、薄膜衣片、糖衣片、肠溶衣片、结肠定位肠溶片、含片、舌下片、可溶片及泡腾片)、胶囊剂(包括硬胶囊剂、软胶囊剂及肠溶胶囊剂),以及滴丸剂的溶散时限检查。凡规定检查溶出度、释放度或融变时限的制剂,不再进行崩解时限检查。
1.2 片剂口服后,需经崩散、溶解,才能为机体吸收而达到治疗目的;胶囊剂的崩解是药物溶出及被人体吸收的前提,而囊壳常因所用囊材的质量,久贮或与药物接触等原因,影响溶胀或崩解;滴丸剂中不含有崩解剂,故在水中不是崩解而是逐渐溶散,且基质的种类与滴丸剂的溶解性能有密切关系,为控制产品质量,保证疗效,药典规定本检查项目。
1.3 本检查法中所称“崩解”,系指口服固体制剂在规定条件下全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应全部通过筛网。如有少量不能通过筛网,但已软化或轻质上浮且无硬芯者,可作符合规定论。
2 .仪器与用具
2.1 崩解仪(见中国药典20##年版二部附录XA的仪器装置)。
2.2 滴丸剂专用吊篮 按2.1项下所述仪器装置,但不锈钢丝筛网的筛孔内径改0.425m。
2.3 烧杯1000ml。
2.4 温度计 分度值1℃。
3.试药与试液
3.1人工胃液(供软胶囊剂和以明胶为基质的滴丸剂检查用) 取稀盐酸16.4ml,加水约800ml与胃蛋白酶10g,摇匀后,加水稀释成1000ml,即得。临用前制备。
3.2 人工肠液(供肠溶胶囊剂检查用) 即磷酸盐缓冲液(含胰酶)(pH6.8)(见中国药典20##年版二部附录XV D缓冲液)。临用前制备。
4.操作方法
4.1 将吊篮通过上端的不锈钢轴悬挂于金属支架上,浸入1000ml 烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25mm,烧杯内盛有温度为37℃±1℃的水(或规定的溶液),调节液面高度使吊篮上升时筛网在液面下15mm处。除另有规定外,取供试品6片,分别置上述吊篮的玻璃管中,每管各加 片,立即启动崩解仪进行检查。
4.2 片剂
4.2.1口服普通片 按4.1项下方法检查,各片均应在15分钟内全部崩解。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
4.2.2 薄膜衣片 按4.1项下方法检查,并可改在盐酸溶液(9→1000)中进行检查,各片均应在30分钟内全部崩解。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
4.2.3 糖衣片 按4.1项下方法检查,各片均应在1小时内全部崩解。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
4.2.4 肠溶衣片 按4.1项下方法,先在盐酸溶液(9→1000)中检查2小时,每片均不得有裂缝、崩解或软化等现象;继将吊篮取出,用少量水洗涤后,每管各加档板1块,再按上述方法在磷酸盐缓冲液(pH6.8)中进行检查,各片均应在1小时内全部崩解。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
4.2.5 结肠定位肠溶片 除另有规定外,先在盐酸溶液(取9ml盐酸,加水至1000ml)及pH6.8 以下的磷酸盐缓冲液中,每片均不得有裂缝、崩解或软化等现象(具体检查用溶液及检查时间在品种项下规定);继将吊篮取出,用少量水洗涤后,每管各加挡板1块,再按上述方法,在pH7.8~8.0的磷酸盐缓冲液中1小时内应全部释放或崩解,片芯亦应崩解。如有1片不能完全崩解,应另取6片复试,均应符合规定。
4.2.6 含片 除另有规定外,按4.1项下方法检查6片,各片均应在30分钟内全部崩解或溶化。如有1片不能完全崩解,应另取6片复试,均应符合规定
4.2.7 舌下片 除另有规定外,按4.1项下方法检查6片,各片均应在5分钟内全部崩解并溶化。如有1片不能完全崩解,应另取6片复试,均应符合规定。
4.2.8 可溶片 除另有规定外,水温为15℃~25℃,按4.1项下方法检查6片,
各片均应在3分钟内全部崩解并溶化。如有1片不能完全崩解,应另取6片复试,均应符合规定。
4.2.9 泡腾片 取1片,置250ml烧杯中,烧杯内盛有200ml水,水温为15℃~25℃,有许多气泡放出,当片剂或碎片周围的气体停止逸出时,片剂应溶解或分散在水,1中,无聚集的颗粒剩留。除另有规定外,按上述方法检查6片,各片均应在 分钟内崩解。如有1片不能完全崩解,应另取6片复试,均应符合规定。
5.注意事项
5.1 在测试过程中,烧杯内的水温(或介质温度)应保持在37℃±1℃。
每测试一次后,应清洗吊篮的玻璃内壁及筛网、档板等,并重新更换水或规定的介质。
6.记录
记录应包括仪器型号、制剂类型及测试条件(如包衣、肠溶或薄膜衣、硬或软胶囊、介质等),崩解或溶散时间及现象,肠溶衣片(胶囊)则应记录在盐酸溶液中有无裂缝、崩解或软化现象等。初试不符合规定者,应记录不符合规定的片(粒)数及现象、复试结果等。
7.结果与判定
7.1 供试品6片(粒),每片(粒)均能在规定的时限内全部崩解(溶散),判为符合规定。如有少量不能通过筛网,但已软化或轻质上浮且无硬芯者,可作符合规定。
7.2 初试结果,到规定时限后如有1片不能完全崩解(溶散),应另取6片复试,各片在规定时限内均能全部崩解(溶散)。仍判为符合规定。
7.3 初试结果中如有2片(粒)或2片(粒)以上不能完全崩解(溶散),或在复试结果中有1片(粒)或1片(粒)以上不能完全崩解(溶散),即判为不符合规定。
7.4 肠溶衣片(胶囊)在盐酸溶液(9→1000)中检查时,如发现裂缝,崩解或软化,即判为不符合规定。
肠溶衣片(胶囊)初试结果中,在磷酸盐缓冲液(pH6.8)或人工肠液介质中如有2片(粒)或2片(粒)以上不能完全崩解,即判为不符合规定,如仅有1片(粒)不能完全崩解,应另取6片(粒)复试,均应符合规定。
(2)澄清度检查
澄清度是检查药品溶液的浑浊程度,即浊度。药品溶液中如存在细微颗粒,当直射光通过溶液时,可引致光散射和光吸收的现象,致使溶液微显浑浊;所以澄清度可在一定程度上反映药品的质量和生产工艺水平。澄清度检查法(中国药典20##年版二部附录IXB)是用规定级号的浊度标准溶液与供试品溶液比较,以判定药品溶液的澄清度或其浑浊程度;
1.仪器与用具
1.2.1、比浊用玻璃管内径15—16mm,平底,具塞,以无色硬质中性玻璃制成,要求供试品管与标准管的内径、标线刻度(距管底为40 mm)一致;
1.2.2、伞棚灯用澄明度检查装置照度为1000lx;
2.试药与试液
1.3.1、硫酸阱和乌洛托品均应符合中国药典规定;
1.3.2、浊度标准贮备液的制备称取硫酸肼1.00g 置100ml量瓶中,加水适量使溶解,必要时可在40C的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4—6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时, 即得。本液置冷处避光保存,可在两个月内使用,用前摇匀;
1.3.3、浊度标准原液的制备取浊度标准贮备液15.Oml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量、置1cm吸收池中,照分光光度法(中国药典20##年牌 二部附录IVA)在550nm的波长处测定,其吸收度应在0.12—0.15范围内。本液应在48小时内使用,用前摇匀;
1.3.4、浊度标准液的制备取浊度标准原液与水,按下表配制,即得。本液应临用时制备,使用前充分摇匀;

3.操作方法
1.4.1、除另有规定外,将一定浓度的供试品溶液与该品种项下规定的浊度标准液,分别置于配对的比浊用玻璃管中,液面高度为40mm,在浊度标准液制备5分钟后,同置黑色背景上,在漫射光下从比色管上方向下观察,比较,或置于伞棚灯下,照度为1000lx,从水平方向观察比较,用以检查溶液的澄清度或其浑浊程度;
1.4.2、在进行比较时,如供试品溶液管的浊度接近标准管时,应将比浊管交换位置后再行观察;
4.注意事项
1.5.1、制备澄清度检查用的浊度标准贮备液、原液和标准液,均应用澄清的水(可用0.45μm孔径滤膜或G5垂熔玻璃漏斗滤过而得);
1.5.2、浊度标准贮备液、浊度标准原液、浊度标准液,均应按规定制备、使用,否则影响结果;
1.5.3、温度对浊度标准贮备液的制备影响显著,因此规定两液混合时的反应温度应保持在25±1℃;
1.5.4、用于配制供试品溶液的水,均应为注射用水或新沸放冷的澄清水;
1.5.5、供试品溶液配制后,应在5分钟内进行检视;
5.计算与记录
应记录供试品溶液制备方法、浊度标准液的级号、比较结果等。
6.判定标准
比较结果,如供试品溶液管的浊度浅于或等于浊度标准液0.5级号的,即为澄清;如浅于或等于规定的浊度标准的液级号的,判为符合规定;如浓于规定浊度标准液级号的,则判为不符合规定。
(3)注射用无菌粉末装量差异检查法
1.目的:
建立注射用无菌粉末装量差异检查法标准操作规程,控制各瓶间装量的一致性,以保证使用剂量的准确。
2.程序:
A.仪器与用具:分析天平感量1mg或0.1mg(适用于检查装量小于0.1g的粉针剂)
B.检查法:
a.取供试品5瓶(支),除去铝盖和瓶签(若为纸标签,用水润湿后除去纸屑;若为直接在玻璃上印字标签,用适当有机溶媒擦除字迹),容器外壁用乙醇洗净,置干燥器内放置1-2小时,俟干燥后,分别编号,依次放于固定位置。
b.轻扣橡皮塞或安瓿颈,使其上附着的粉末全部落下,分别精密称定每瓶(支)的重量,开启容器(注意避免玻璃屑等异物落入容器中),倾出内容物,容器用水、乙醇洗净,依次放回原固定位置,在适当的条件下干燥后,再分别精密称定每一容器的重量,即可求出每1瓶(支)的装量和平均装量。
c.复试、初试中,如有1瓶的装量超过装量差异限度规定时,另取10瓶(支)
按a、b项下复试。
C.记录与计算:
a.记录每次称量数据。
b.根据每瓶(支)的重量与其空瓶重之差,求算每瓶(支)内容物重量。
 c.每瓶(支)内容物重量之和除以5(复试时除以10),即得平均装量( m ),
c.每瓶(支)内容物重量之和除以5(复试时除以10),即得平均装量( m ),
保留3位有效数字。

 d.按下表规定装量差异限度,求出允许装量范围(m±m×装量差异限度)。
d.按下表规定装量差异限度,求出允许装量范围(m±m×装量差异限度)。
注射用无菌粉末装量差异限度规定

D、结果与判定:
a.每1瓶(支)中的装量与平均装量相比较,均末超过者,判为符合规定。
b.每1瓶(支)中的装量与平均装量相比较,超过1瓶者,判为不符合规定。
c.初试结果仅有1瓶(支)的装量超过允许装量范围时,另取10瓶(支)复试。复试结果每1瓶(支)的装量与其允许装量范围相比较,均末超过者,可判为符合规定;若有1瓶(支)或1瓶(支)以上超过时,判为不符合规定。
E注意事项:
a.开启安瓿装粉针时,应避免玻璃屑落入或溅失。
b.用水、乙醇洗涤倾去内容物后的容器时,慎勿将瓶外编号的字迹擦掉,以免影响称量结果;并将空容器与原橡皮塞或安瓿颈部配对放于原固定位置。
c.空容器的干燥,一般可用60—70℃加热1—2小时,也可在干燥器内干燥
较长时间。
d. 称量空容器时,应注意瓶身与瓶塞(或折断的瓶颈部分)的对号。
(4)溶液颜色检查法
溶液颜色检查法系控制药品有色杂质限量的方法,是对通常利用紫外检测器进行有关物质高效液相色谱法测定的有效补充。有色杂质的来源一是由生产工艺中引入,二是在贮存过程中由于药品不稳定降解产生。《中国药典》20##年版二部附录Ⅸ A溶液颜色检查法项下收载了三种检查方法:目视法、紫外-可见分光光度法和色差计法,并增加了品种中规定的“无色或几乎无色的定义”。“无色”系指供试品溶液的颜色相同于所用溶剂,“几乎无色”系指供试品溶液的颜色浅于用水稀释1倍的相应色调1号标准比色液。
第一法
1.简述
本法为目视比色法,即将供试品溶液与各色调标准比色液进行比较,以判断结果。
2.仪器与用具
2.1 纳氏比色管 用具有10ml刻度标线的25ml纳氏比色管或专用管,要求玻璃质量较好,管壁薄厚、管径、色泽、刻度标线一致。
2.2 白色背景要求不反光,一般用白纸或白布。
3.试药与试液
3.1 重铬酸钾用基准试剂,硫酸铜及氯化钴均为分析纯试剂。
3.2 比色用重铬酸钾液 精密称取在120℃干燥至恒重的基准重铬酸钾0.4000g,置 ’500ml量瓶中,加适量水溶解并稀释至刻度,摇匀,即得。每1ml溶液中含0.800mg的K2Cr2O7。
3.3 比色用硫酸铜液 取硫酸铜约32.5g,加适量的盐酸溶液(1→40)使溶解成’$$%&,精密量取10ml,置碘瓶中,加水50ml、醋酸4ml与碘化钾2g,用硫代硫酸钠滴定液(0.1mol/L)滴定,至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失。每1ml的硫代硫酸钠滴定液(0.1mol/L)相当于24.97mg的CuSO4·5H2O。根据上述测定结果,在剩余的原溶液中加适量的盐酸溶液(1→40),使每1ml溶液含62.4mg的CuSO4·5H2O,即得。
3.4 比色用氯化钴液 取氯化钴约32.5g,加适量的盐酸溶液(1→40)使溶解成500ml,精密量取2ml,置锥形瓶中,加水200ml,摇匀,加氨试液至溶液由浅红色转变至绿色后,加醋酸:醋酸钠缓冲溶液(pH6.0)10ml,加热至60℃,再加二甲酚橙指示液5滴,用乙二胺四醋酸二钠滴定液(0.05mol/L)滴定至溶液显黄色。每1ml的乙二胺四醋酸二钠滴定液(0.05mol/L)相当于11.90mg的CoCl2·6H2O。根据上述测定结果,在剩余的原溶液中加适量的盐酸溶液(1→40),使每1ml溶液中含59.5mg的CoCl2·6H2O,即得。
3.5 各种色调标准贮备液的制备 按下表量取比色用重铬酸钾液、比色用硫酸铜液和比色用氯化钴液与水,摇匀,即得。
表1 各种色调标准贮备液的配制表
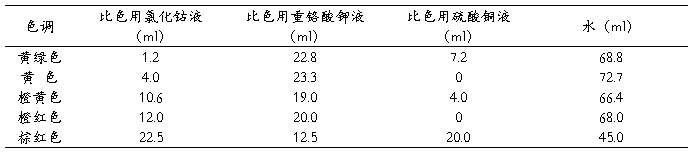
3.6 各种色调色号标准比色液的制备 按表2量取各该色调标准贮备液与水,摇匀,即得。
表2 标准比色液制备

4.操作方法
除另有规定外,取各品种项下规定量的供试品,加水溶解,置于25ml的纳氏比色管中,加水稀释10ml。另取规定色调和色号的标准比色液10ml,置另一25ml的纳氏比色管中,两管同置白色背景上,自上向下透视;或同置白色背景前,平视观察;比较时可在自然光下进行,以漫射光为光源。供试品管呈现的颜色与对照管比较,不得更深。
5.注意事项
5.1 所用比色管应洁净、干燥,洗涤时不能用硬物洗刷,应用铬酸洗液浸泡,然后冲洗、避免表面粗糙。
5.2 检查时光线应明亮,光强度应能保证使各相邻色号的标准液清晰分辨。
5.3 如果供试品管的颜色与对照管的颜色非常接近或色调不尽一致,使目视观察无法辨别二者的深浅时,应改用第三法(色差计法)测定。
6.记录
应记录供试品溶液的制备方法、标准比色液的色调色号,比较结果。
7.结果与判定
供试品溶液如显色,与规定的标准比色液比较,颜色相似或更浅,即判为符合规定;如更深,则判为不符合规定。
第二法
1.简述
本法为紫外-可见分光光度法。
2.仪器
紫外-可见分光光度计。
3.操作方法
3.1 除另有规定外,如供试品为原料药,称取各品种项下规定量的供试品,加水溶解使成10ml(或加水溶解使成规定量的体积),必要时滤过,取续滤液照紫外-可见分光光度法于规定的波长处测定吸光度。
3.2 如供试品为固体制剂,取该供试品研细,称取该药品项下规定量的细粉,加水溶解使成规定量的体积,振摇或用其他规定的方法使溶解,滤过,取续滤液照紫外.可见分光光度法于规定波长处测定吸光度。
3.3 如供试品为注射液或液体制剂,量取供试品适量,加水或规定的溶剂稀释成规定的浓度(供试品的浓度与规定浓度相同时,可直接测定),照紫外-可见分光光度法,以水或规定的溶剂为空白,于规定波长处测定吸光度。
4.注意事项
3.1与3.2中的滤过是指在规定“滤过”而无进一步说明时,使液体通过适当的滤纸或相应的装置过滤,直到滤液澄清。弃去初滤液,取续滤液测定。
5.记录
应记录仪器型号与测定波长;供试液的制备方法、吸光度读数。
6.结果判定
按规定溶剂与浓度配制成的供试液进行测定,如吸光度小于或等于规定值,判为符合规定;大于规定值,则判为不符合规定。
第三法
1.简述
本法是通过色差计直接测定药品溶液的透射三刺激值,对其颜色进行定量表述和分析的方法。当供试品溶液的颜色处于合格边缘,目视法难以准确判断时,以及供试品与标准比色液色调不一致时,更可显示本法的优越性。判定方法是直接将标准比色液和供试品溶液的三刺激值(或色品坐标值)进行比较,或通过标准比色液和供试品溶液分别与水的色差值进行比较。
2.仪器及其性能测试
2.1 色差计:测色色差计是由照明、探测及读数处理系统三大部分所组成。照明系统多为白炽光源,也有用微型脉冲氙灯的;探测器多为硒(硅)光电池、硅光电二级管或光电管,并配以拟合人眼色觉特性的滤光器;读数系统为数字显示表;其输出结果除三刺激值外,还有根据CIE(国际照明委员会)表色系统自动计算而得的各种色度学参数(可根据需要进行选定)。
2.2 仪器的性能测试:根据中华人民共和国国家技术监督局颁布的测色色差计检定规程(JJG595-89)的规定进行检定。仪器首先应符合照度条件,它决定着仪器测色准确度的高低,为减少测色误差,仪器一般配备有专用工作白板、色板或其它基准物质以校正仪器,检定项目除准确度外,还有重复性等。
3..测定法操作法与结果判定
除另有规定外,用水对仪器进行校准,并把水作为第一份样品进行测定,仪器将给出水的颜色值,接着依次取按各品种项下规定的方法配制的供试品溶液和标准比色液,分别进行测定,仪器不仅可测出两种溶液的颜色值,还给出供试品溶液和标准比色液分别对水的色差值(ΔE*),如供试品溶液与水的色差值不超过标准比色液与水的色差值,则判定为符合规定,反之则判定为不符合规定。
4.注意事项
4.1 测定池应洁净透明,可用洗液浸泡清洗。
4.2 水的三刺激值为X=94.81,Y=100.00,Z=107.32。如测定后水的三刺激值中任一值与标准值的偏差大于1.5,则应重新校准仪器。
4.3 供试品溶液配制后需立即测定,如溶液中含有气泡,可短时超声去除后再行测定。
4.4 本法只适用于测定澄清溶液的颜色,如供试品溶液浑浊,则影响颜色测定的结果。
4.5 如品种项下规定的标准比色液的色调有两种(或两种以上),但目视可判定供试液的色调与其中一种相同或接近,则可直接与该色调标准比色液的色差值(ΔE*)进行比较判断;如供试液的色调处于二者之间,目视难于判定更接近何种标准比色液的色调时,则应将测得的供试品溶液与水的色差值(ΔE*)与两种色调标准比色液与水的色差值的平均值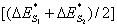 进行比较来判定。
进行比较来判定。
(5)可见异物检查法
1.定义
可见异物是指存在于注射剂、滴眼剂中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50μm。包括注射液或滴眼液中存在的金属屑、玻璃屑、长度或最大粒径超过2mm纤毛和块状物等明显外来的异物 ,以及注射液或滴眼液中存在可见异物以外的异物。如白点、短纤毛、白块等
2.来源
可见异物的产生主要有两种渠道。
(1)外源性污染,这主要是生产环境达不到一定洁净条件,生产材料、包装容器处理不得当,如纤毛、金属屑、玻屑等。安瓿的清洗过程中带入清洗过程:声波震荡、注射用水冲洗、隧道烘箱干燥、灭菌。隧道烘箱的高效过滤器出现穿透时,热风循环会带着细小的碎玻屑通过高效过滤器,导致洗瓶效果不好,灯检时发现较多碎玻屑,影响可见异物。灌装时由于药液喷溅在安瓿瓶口,瓶口在热封时,喷溅的药液遇高温,形成炭化黑点,在包装运输过程中,炭化物被药液浸泡,而脱落在药液中,形成可见异物,
(2)内源性污染,它主要是溶剂、制剂、处方或工艺选择不合理,如原料中存在的不溶物,析出的沉淀物、结晶等,因此,检查可见异物也等于间接检查了上述环节是否达标,上述因素是否合理,甚至还可以判定某种药物成分是否适合做成注射剂这类剂型。
3.检查方法
一般常用灯检法,也可以用光散射法。灯检法不适用的品种(如用有色透明容器包装或液体色泽较深的品种)应选用光散射法
灯检法:
除另有规定外,取供试品20支(瓶),除去标签,擦净容器外壁,轻轻旋转或翻转容器使药液中的可见异物悬浮(注意不使药液产生气泡),必要时将药液转移至洁净透明的专用玻璃容器中。
? 置供试品于遮光板边缘处,在明视距离(指供试品至人眼的距离,通常为25cm),分别在黑色和白色背景下,手持供试品颈部使药液轻轻翻转,用目检视。
无色注射剂或滴眼剂的检查,光照度应为1000~1500l;明塑料容器或有色溶液注射剂或滴眼剂的检查,光照度应为2000~3000lx;型注射剂和滴眼剂,光照度为4000lx,仅检查色块、纤毛等可见异物。
检查人员条件 远距离和近距离视力测验,均为4.9或4.9以上(矫正后视力应为5.0或5.0以上)应无色盲。
检验室条件 暗室中检查,并避免引入可见异物。当溶解注射用无菌粉末和无菌原料药制备供试品溶液时,或供试品溶液的容器(如不透明、不规则形状容器等)不适于检测,需转至洁净透明的专用玻璃容器中时,均应在100级的洁净环境(如层流净化台)中进行。
大容量样品检测 50ml或50ml以上的注射液按直、横、倒三步法旋转检视。
4.查过程中注意的问题
照度的选择 规定选择合适的照度进行检查。如应用高照度的而选用低照度,则有可能看不到可能有的其他可见异物。反之,则有可能是看到异物,但在规定的照度看不到。
翻转容器在检查过程中,应轻轻旋转和翻转容器,不要用力过大,避免产生大量气泡,影响观察。其对待粘稠液体,气泡不是规则的圆形,有时会误认为是白块。
观察 怀疑有小的玻璃屑又不易找到时,可以先看容器的底部,有亮的突起,振摇后可以移动。可能判断有异物(视情况定可见异物还是其他可见异物)
5.结果判定
如检出其他可见异物(如2mm以下的短纤毛及点、块等)的供试品仅有1支(瓶),应另取20支(瓶)同法复试,均不得检出
溶液型非静脉用注射液(肌注)20支(瓶)供试品均不得检出金属屑、玻璃屑、长度或最大粒径超过2mm纤毛和块状物等明显外来的可见异物,并在旋转时不得检出烟雾状微粒柱。
当药品标注用法即能肌注又能静脉注射用时,应按静脉注射判定。
判不符合定情况总结如下:有1支检出可见异物;肌注的有3支检出其他可见异物;静脉注的有2支检出其他可见异物。
五、实习总结及体会
十天的实习很快就结束了,时间虽短,但我学到了很多东西。实习是对一个应届大学毕业生来说是非常重要的学习机遇,是我们提前接触社会的一个途径,。这次在山西渊源有限公司为期近半个月的实习生活让我学到了很多东西,对我而言有着十分重要的意义。
首先,它让我提高了沟通人际关系的能力,提前体验上班族生活。其次,在实习过程中,我也丰富了自己的专业知识,积累了工作经验,为以后走上工作岗位夯实基础,而且还找到了自身的不足之处,早日弥补,增强了自己适应社会的能力。同时让我更深刻的了解了社会,如何更便捷的融入社会,它不仅使我在理论上对制药技术这个领域有了全新的认识,而且在实践能力上也得到了提高,真正地做到了学以致用,让我学到了许多书本上学不到的东西,有效的锻炼了自己,长了见识,开拓了视野。
实习是我们把学校学到的理论知识应用在实际中的一次尝试,是我们迈向社会的第一步,通过这次实习,我发现了不少问题,自己的缺点、不足,早该摒弃陋习。也使我知道了自己所学的知识太肤浅,专业知识在实际运用中的匮乏,让我更加明白我需要学习的太多,使我了解到必须让自己懂得更多才能在当今竞争激烈的社会中拥有一席之地。
我坚信通过这一段时间的实习,所获得的实践经验对我终身受益,在我毕业后的实际工作中将不断的得到验证,我会不断的理解和体会实习中所学到的知识,在未来的工作中我将把我所学到的理论知识和实践经验不断的应用到实际工作中去,充分展示自我的个人价值和人生价值,为实现自我的理想和光明的前程努力。
