高一上学期化学方程式总结
【金属元素】 【钠元素】 4Na+O2==2Na2O 2Na+O2
Na2O2
NaOH+SO2(足量)==NaHSO3 2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 3NaOH+FeCl3==Fe(OH)3↓+3NaCl NaHSO4==Na++ H++SO42- Mg+2H2O
Mg(OH) 2+H2↑
2Na+2H2O==2NaOH+H2↑ 2Na2O2+2CO2==2Na2CO3+O2↑ 2NaOH+SO2(少量)==Na2SO3+H2O 【铝元素】 4Al+3O2==2Al2O3
Al2O3+2NaOH==2NaAlO2 + H2O 2Al2O32Al(OH)3H3AlO3
4Al+ 3O2↑ Al 2O3 + 3H2O H2O+HAlO2
2Na2O2+2H2O==4NaOH+O2↑(Na2O2+2H2O==2NaOH+H2O2;2H2O2==2H2O+O2↑)
2Al+6H2O2Al(OH) 3+3H2↑
AlCl3 + 3NH3·H2O=Al(OH)3↓+3NH4Cl NaAlO2+HCl+H2O=NaCl+Al(OH)3↓ 2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3 3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
(2Al+6H2O==2Al(OH)3+3H2↑;Al(OH)3 + NaOH==NaAlO2 + 2H2O) 【铁元素】 3Fe+2O23Fe+4H2O(g)
Fe3O4
Fe3O4+3H2↑
FeCl3+3NaOH==Fe(OH)3↓+3NaCl FeCl3+3H2O
Fe(OH)3(胶体)+3HCl
2FeCl3+Fe==3FeCl2 2FeCl3+Cu==2FeCl2+CuCl2 【非金属元素】 【氮元素】 N2+H2N2+O2
NH3 2NO
2FeCl2+Cl2==2FeCl3
4Fe(OH)2+ 2H2O+O2 ==4Fe(OH)3
Cu+4HNO3(浓)==Cu(NO3)2 +2NO2↑+2H2O 3Cu+8HNO3(稀)==3Cu(NO3)2 +2NO↑+4H2O C+4HNO3(浓)==CO2↑+4NO2↑+2H2O NH4Cl
NH3↑+HCl↑
2NO+O2==2NO2
3NO2 +H2O==2HNO3 + NO 4NO+3O2+2H2O==4HNO3 4NO2+O2+2H2O ==4HNO3 4HNO3NH3+H2O4NH3+5O2【硅元素】 2C+ SiO2Si+O2
2CO↑ + Si SiO2
4NO2↑+ O2↑+ 2H2O NH3·H2O4NO + 6H2O
NH3 + HCl==NH4Cl NH4HCO3
NH4+OH
+
-
NH3↑+ H2O +CO2↑
CaCl2+2NH3↑+2H2O NH3↑+NaCl+H2O
2NH4Cl+Ca(OH)2NH4Cl +NaOH
Si+2NaOH+ H2O==Na2SiO3+2H2↑ SiO2+2NaOH ==Na2SiO3+H2O
SiO2+ 4HF==SiF4+2H2O SiO2+CaOSiO2+Na2CO3【硫元素】 H2 + SFe + S2Na + S2Cu + SSO2 + H2
O
H2S FeS Na2S Cu2S
H2SO3 CaSiO3
Na2SiO3+CO2↑
SiO2+CaCO3CaSiO3+ CO2↑
Na2SiO3+2HCl==2NaCl+ H2SiO3↓ Na2SiO3+H2O+CO2==Na2CO3+H2SiO3↓
2SO2+O22SO3
SO2+Ca(OH)2==CaSO3↓+ H2O SO3+H2O==H2SO4 H2SO4(浓)+2NaCl2H2SO4(浓)+Cu2H2SO4(浓)+C
Na2SO4+2HCl? CuSO4+2H2O+SO2↑ CO2↑+2H2O+2SO2↑
SO2 + 2NaOH==Na2SO3 + H2O SO2+Na2SO3+H2O==2NaHSO3
SO2+Cl2+2H2O==H2SO4+2HCl(Br2、I2 类似) SO2(少量)+2NH3+H2O==(NH4)2SO3 SO2(足量)+NH3+H2O==NH4HSO3 【氯元素】 Cl2+Cu3Cl2+2FeCl2+2 NaCl2 + H2
CuCl2 2FeCl3 2NaCl 2HCl
2Na2SO3+O2==2Na2SO4
Na2SO3+H2SO4==Na2SO4+SO2?+H2O Na2SO3+H2O+Cl2==Na2SO4 +2HCl
Cl2+H2O==HCl+HClO
Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+H2O+ CO2(少量)==CaCO3↓+2 HClO Ca(ClO)2+2H2O+ 2CO2(足量)==Ca(HCO3)2↓+2 HClO Ca(ClO)2+2HCl==CaCl2+2 HClO(强酸制弱酸) 2HClO
2HCl+O2↑
HClO+ H2O+SO2 = H2SO4+HCl Br2 + H2 == 2HBr 2Cl2+2NaBr==2NaCl+Br2 Cl2 +2KI==2KCl+I2 Br2 +2KI==2KBr+I2 4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
NaBr+AgNO3=AgBr↓(浅黄色)+NaNO3 NaI + AgNO3==AgI↓(黄色)+ Na NO3 2AgBr
2Ag+Br2
第二篇:高一第一学期化学方程式总结
高一第一学期化学方程式总结
氯气:
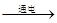 1、制备:
1、制备:
工业制备:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
阳极产物:氯气(湿润的淀粉碘化钾试纸检验——变蓝)
阴极产物氢氧化钠(酚酞——变红)和氢气(爆鸣法)

2、实验室制备:MnO2+4HCl(浓) → MnCl2+Cl2↑+2H2O
装置见笔记
氯气化学性质:


1、2Fe+3Cl2→2FeCl3产生褐色烟,溶液棕黄色

2、2Na+Cl2→ 2NaCl

3、H2+Cl2→2HCl点燃时候:苍白色的火焰,安静燃烧,瓶口有白雾(工业制备HCl)

H2+Cl2→2HCl 混合爆炸
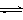 4、Cl2+H2O HCl+HClO (三分四离)
4、Cl2+H2O HCl+HClO (三分四离)
5、Cl2+2NaOH→NaCl+NaClO+H2O
新制氯水
(1)、淡黄绿色、有氯气的刺激性气味
(2)、成分:
分子:Cl2,H2O,HClO
离子:H+,Cl-,ClO-,OH-
漂粉精
1、原料:氯气、消石灰
2、制取原理:
2Cl2+2Ca(OH)2→CaCl2+Ca(ClO)2+2H2O
3、漂粉精的主要成分:
CaCl2与Ca(ClO)2混合物
4、有效成分:
Ca(ClO)2
5、起漂白、消毒作用的物质:
HClO
6、漂白原理:Ca(ClO)2→HClO
Ca(ClO)2+2HCl→CaCl2+2HClO(工厂)
Ca(ClO)2+2CO2+2H2O → Ca(HCO3)2+2HClO(家庭)
7、漂粉精的保存:密闭、干燥、阴暗处保存
8、失效原理:(两个)
Ca(ClO)2+2CO2+2H2O→Ca(HCO3)2+2HClO

2HClO→2HCl+O2↑
实验室制取氯化氢

NaCl+H2SO4(浓)→NaHSO4+HCl↑
装置见笔记
海水提取溴的氧化原理(离子方程式)
Cl2+2Br—→ Br2 + 2Cl—
海水提取碘的氧化原理(离子方程式)
Cl2+2I—→ I2 + 2Cl—
Cl-,Br-,I-检验
(AgNO3与HNO3)
化学反应方程式 离子方程式
NaCl+AgNO3®AgCl¯+NaNO3 Cl—+Ag+®AgCl¯(白色)
NaBr+AgNO3®AgBr¯+NaNO3 Br—+Ag+®AgBr¯(淡黄色)
KI +AgNO3®AgI ¯ +KNO3 I— +Ag+®AgI¯(黄色)
AgX性质见光分解

2AgX ® 2Ag+ X2↑X=Cl、Br、I
卤素单质的化学性质递变规律(从氟到碘)
1、 卤素单质化学活泼性(氧化性):F2>Cl2>Br2>I2
2、 卤素离子的还原性 : F- < Cl- <Br- < I-
3、 卤素单质与氢气(水)反应能力减弱
4、 卤化氢的稳定性:HF>HCl>HBr>HI
电离方程式:
HCl®H++Cl—
H2SO4®2H++SO42—
NaOH®Na++OH—
Ba(OH)2®Ba2++2OH—
KMnO4®K++MnO4—
铜锌原电池:
反应方程式:Zn+H2SO4 ® ZnSO4 + H2↑
离子方程式:Zn+2H+® Zn2++ H2↑
负极(锌):Zn-2e® Zn2+(氧化反应)
正极(铜):2H+ +2e® H2↑(还原反应)
