原子、化学键知识规律总结
一、原子结构
A
1.几个量的关系(ZX)
质量数(A)=质子数(Z)+中子数(N)(原子的近似相对原子质量) 质子数=核电荷数=原子序数=原子的核外电子数 离子电荷数=质子数-核外电子数 2.同位素
(1)要点:同——质子数相同,异——中子数不同,微粒——原子(核素)。 (2)特点:同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。
注意:同种元素的同位素可组成不同的单质或化合物,如H2O和D2O是两种不同的物质。
3.相对原子质量
(1)原子的相对原子质量:以一个12C原子质量的1/12作为标准,其它原子的质量跟它相比较所得的数值。它是相对质量,单位为1,可忽略不写。
(原子的近似相对原子质量)
(2)元素的相对原子质量:是按该元素的各种同位素的原子百分比与其相对原子质量的乘积所得的平均值。元素周期表中的相对原子质量就是指元素的相对原子质量。
4.核外电子排布规律
(1)核外电子是由里向外,分层排布的。
(2)各电子层最多容纳的电子数为2n2个;最外层电子数不得超过8个,次外层电子数不得超过18个,倒数第三层电子数不得超过32个。
(3)以上几点互相联系。
核外电子排布规律是书写结构示意图的主要依据。 5.原子和离子结构示意图
注意:①要熟练地书写1~20号元素的原子和离子结构示意图。
②要正确区分原子结构示意图和离子结构示意图(通过比较核内质子数和核外电子数)。
6.微粒半径大小比较规律
(1)同周期元素(稀有气体除外)的原子半径随原子核电荷数的递增逐渐减小。
(2)同主族元素的原子半径和离子半径随着原子核电荷数的递增逐渐增大。 (3)电子层结构相同的离子,核电荷数越大,则离子半径越小。 (4)同种元素的微粒半径:阳离子<原子<阴离子。
(5)稀有气体元素的原子半径大于同周期其它元素原子半径。
(6)电子层数多的阴离子半径一定大于电子层数少的阳离子半径,但电子层数多的阳离子半径不一定大于电子层数少的阴离子半径。
二、化学键与分子间作用力
表2离子键、共价键和金属键的比较
四、共价键的类型
表3非极性键和极性键的比较
五、分子的极性
1.非极性分子和极性分子
表4 非极性分子和极性分子的比较
2.常见分子的类型与形状
表5常见分子的类型与形状比较
第二篇:化学键知识总结
化学键知识总结
一、经典共价键理论(八电子规则)
基本思想:当ns、np原子轨道充满电子,会成为八电子构型,该电子构型是稳定的,所以在共价分子中,
每个原子都希望成为八电子构型(H原子为2电子构型)。
二、近代价键理论
1.经典价键理论遇到许多困难:
(1) 两个电子配对后为什么不相互排斥?
(2) 在有些化合物中,中心原子周围的价电子总数超过8, 为什么仍然稳定存在?
(3) 根据静电理论,原子核对成键电子对的吸引只具有共价键能的5%,那么大部分共价键能从何而来?
(4) 经典共价键理论不能解释共价键的方向性和饱和性!
2.近代价键理论的内容
(1) 两个原子形成一个共价键时,两个原子必须各提供一个未成对电子(即单电子)且它们的自旋方向相反。
(2) 两个原子形成共价键时,其成键轨道能量要相近。例如H2中1s~1s轨道成键;HF中H的1s与F的
2p轨道成键等。
(3) 共价键的形成在尽可能的范围内一定要采取在电子云密度最大方向上进行重叠(即获得最大的键能,
使分子处于最稳定的状态)¾¾ 解决了共价键的方向性。但必须注意的是,由于s电子云是球形的,所以
s-s形成的共价键无方向性。
3.共价键的特点
(1) 饱和性:一个原子有几个未成对电子,就可以和几个自旋相反的电子配对,形成共价键。
(2) 方向性:s-s原子轨道的重叠无方向性,s-p、p-p、p-d原子轨道的重叠都有方向性。
(3) 共价键的类型
a.σ键:沿着键轴的方向,发生“头碰头”原子轨道的重叠而形成的共价键,称为σ键。
b.π键:原子轨道以“肩碰肩”的方式发生重叠而形成的共价键,称为π键。
4.杂化轨道理论
(1) 问题的提出:
a.基态C原子只有2个单电子,为何可以与4个 原子形成CH4分子?即如何来解决共价键的饱和性呢?
原子形成CH4分子?即如何来解决共价键的饱和性呢?
b.水分子中的∠HOH = 104.5°,与根据2个H原子的1s原子轨道与O原子的2px、2py原子轨道重叠,形
成90°角不符。即如何来解决共价键的方向性?
(2) Pauling 的杂化轨道理论¾¾ 解决共价键的饱和性和方向性
内容:由不同类型的原子轨道混合起来,重新组成能量相等的新的轨道的过程,称为原子轨道杂化。
例如:在CH4中C原子采取等性sp3杂化,即有四个单电子,所以可以与四个H原子成键,解决了饱和性;sp3杂化轨道的几何构型为正四面体,又解决了方向性问题。所以Pauling 的杂化轨道理论获得了成功。
(3)杂化轨道的类型
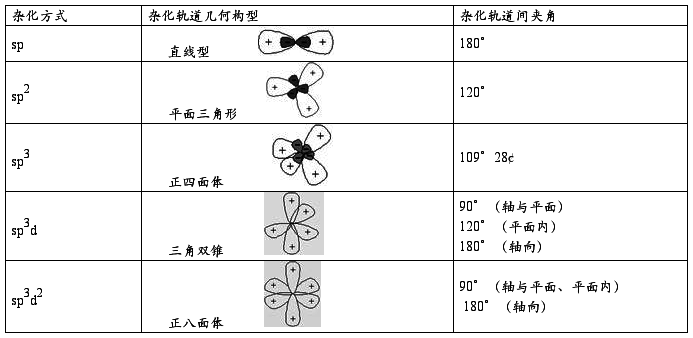
(4) 杂化轨道理论的引入解决了共价键的饱和性和方向性。实际上只有已知分子几何构型,才能确定中心
原子的杂化类型。例如:BF3和NF3,前者为平面三角形,后者为三角锥型,我们就可以推断BF3中的B
原子采取sp2杂化,NF3中的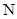 原子采取sp3杂化。
原子采取sp3杂化。
(5) 在不同的分子或原子团中,同一种中心原子在不同共价分子中可以采取不同的杂化类型。
例如:P原子:PCl3(sp3)、PCl5(sp3d)、PCl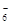 (sp3d2),C原子:C2H6(sp3)、C2H4(sp2)、C2H2(sp)。
(sp3d2),C原子:C2H6(sp3)、C2H4(sp2)、C2H2(sp)。
那么如何来推测未知几何构型的共价分子的几何构型呢?
5.价层电子对互斥理论(Valence Shell Electron Pair Repulsion)(VSEPR理论)
1940年由Sidgwick和Powell提出
(1) 基本思想:在共价分子或共价型离子中,中心原子周围的电子对所占的空间(成键电子对和孤对电
子对)尽可能采用使之本身受到的静电排斥最小的理想的几何构型,即尽可能使中心原子周围的各电子对
的距离达到最大。
(2) 判断分子几何构型的步骤:
a.确定中心原子的杂化类型¾¾ 计算中心原子周围的成对电子对数目和孤对电子对数目。
中心原子上的孤对电子数的确定:
1.中心原子的价电子数=中心原子族序数
2.中心原子与一个端位原子形成共价键用去的电子数=端位原子能接受的电子数=8-端位原子族序数(H=1除外)
3.若是负离子,在中心原子的价电子总数上加负电荷绝对值
4.若是正离子,在中心原子的价电子总数上减正电荷绝对值
5.中心原子剩余的电子数除以2等于中心原子上的孤电子对数。
AXnEm:n+m=2、3、4、5、6中心原子A分别对应 sp 、sp2、sp3、sp3d、sp3d2杂化
b.按照理想的几何构型画出分子几何构型图。
c.如果遇到存在几种可能的结构时,要选择最稳定的结构式,即各电子对间的排斥力最小。对于三角双
锥而言,抓住90°键角之间的排斥力,因为最小角之间的排斥力最大。各电子对之间排斥力的大小顺序为:
孤对电子对-孤对电子对 > 孤对电子对-双键 > 孤对电子对-单键 > 双键-双键 > 双键-单键
> 单键-单键
我们把所有分子的杂化类型和几何构型总结于下表:
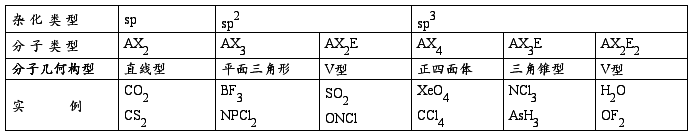

6.键角的讨论 不同的杂化类型,键角不同。
(1) 在相同的杂化类型条件下,孤对电子对越多,成键电子对之间的键角越小。
例如:CH4、NH3、H2O,键角越来越小。
(2) 在相同的杂化类型和孤对电子对条件下,
a.中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离变小,排斥力增大,键角变大。例如:NH3、PH3、AsH3,中心原子电负性减小,键角越来越小。
b.配位原子的电负性越大,键角越小。例如NH3中的∠HNH大于NF3中的
∠FNF。
c.双键、叁键的影响:由于叁键-叁键之间的排斥力 > 双键-双键之间的排斥力 >双键-单键之间的排斥力 > 单键-单键之间的排斥力。
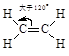
*离域π键(大π键)
(1) 离域π键的形成条件
a.所有参与离域π键的原子都必须在同一平面内,即连接这些原子的中心原子只能采取sp或sp2杂化。
b.所有参与离域π键的原子都必须提供一个或两个相互平行的p轨道
c.参与离域π键的p轨道上的电子数必须小于2倍的p轨道数
(2) 实例
1, 3 -丁二烯 H2C=CH-CH=CH2
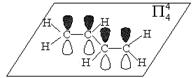
 (m - 电子数,n - p轨道数)
(m - 电子数,n - p轨道数)
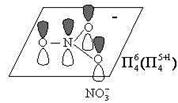
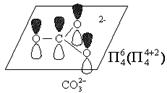
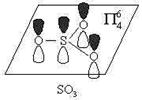
SO3中S原子采取sp2杂化,未杂化的3p轨道上存在一对电子,由于在sp2杂化轨道上有一对电子,所以SO3中有一个氧原子的2p轨道上的电子发生重排而空出了一个p轨道来容纳S原子上的电子对,则该氧原子提供的平行的2p轨道上也是一对电子,所以SO3的四个p轨道提供的p电子数为:2 + 2 + 1 + 1 = 6。
实际上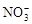 和
和 是等电子体,SO3与它们也是广义的等电子体,所以它们有相同的
是等电子体,SO3与它们也是广义的等电子体,所以它们有相同的 。
。
