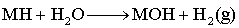不含全部配位反应、鉴定反应、要从同类反应(未全包括)中找出规律
1.XeF6 + 3H2O == XeO3 + 6HF
2.NaBrO3 + XeF2 + H2O == NaBrO4 + 2HF + Xe
3.2F2 + 2H2O == 4HF + O2
4.2F2 + 2OH— (2%)== 2F— + OF2+ H2O
5. 2KHF2 电解 2KF + H2↑ + F2↑
6. 2NaCl + 2H2O 电解 2NaOH + H2↑(阴极区)+ Cl2↑
7. 2IO3― +5HSO3— == 5SO42— + I2 +3H+ + H2O
8. CaF2 + H2SO4 (浓) == CaSO4 + 2HF
9. NaCl + H2SO4 (浓) == NaHSO4 + HCl↑
10.Rb[ICl2] ==(加热) RbCl + ICl
11. 2HIO3 ==(加热) I2O5 + H2O↑
12. I2O5 + 5CO == I2 + 5CO2
13. I2+ 10HNO3 == 2HIO3 + 10NO2↑ + 4H2O
14. 2Cl2 + 2Ca(OH)2 == Ca(ClO)2 + CaCl2 + 2H2O
15. IO3―+ 5I― + 6H+ == 3I2 +3H2O
16. 3Cl2 + 6NaOH(850C) 5NaCl+NaClO3+3HO
17. O3 + 2I― + H2O == O2 + I2 + 2OH—
18. S2O82— + 2H2O == H2O2 + 2HSO4—
19. Cl2 + H2O2 == 2HCl + O2↑
…… …… 余下全文

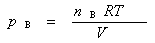 2.组分气体B在相同温度下占有与混合气体相同体积时所产生的压力,叫做组分气体B的分压。
2.组分气体B在相同温度下占有与混合气体相同体积时所产生的压力,叫做组分气体B的分压。 第二章:
第二章: 3.焓:
3.焓: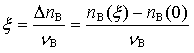 4.反应进度:
4.反应进度: 。分母为化学计量数。在左边取负数。
。分母为化学计量数。在左边取负数。 6.
6.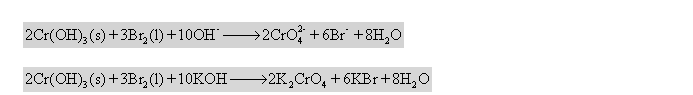


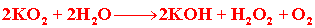


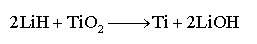
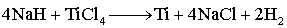 (钛的冶炼)
(钛的冶炼)