1. 化学反应速率:
⑴. 化学反应速率的概念及表示方法:通过计算式:v =Δc /Δt来理解其概念:
①化学反应速率与反应消耗的时间(Δt)和反应物浓度的变化(Δc)有关;
②在同一反应中,用不同的物质来表示反应速率时,数值可以相同,也可以是不同的。但这些数值所表示的都是同一个反应速率。因此,表示反应速率时,必须说明用哪种物质作为标准。用不同物质来表示的反应速率时,其比值一定等于化学反应方程式中的化学计量数之比。如:化学反应mA(g) + nB(g) pC(g) + qD(g) 的:v(A)∶v(B)∶v(C)∶v(D) = m∶n∶p∶q ③一般来说,化学反应速率随反应进行而逐渐减慢。因此某一段时间内的化学反应速率,实际是这段时间内的平均速率,而不是瞬时速率。
⑵. 影响化学反应速率的因素:
I. 决定因素(内因):反应物本身的性质。
Ⅱ. 条件因素(外因)(也是我们研究的对象):
①. 浓度:其他条件不变时,增大反应物的浓度,可以增大活化分子总数,从而加快化学反应速率。值得注意的是,固态物质和纯液态物质的浓度可视为常数;
②. 压强:对于气体而言,压缩气体体积,可以增大浓度,从而使化学反应速率加快。值得注意的是,如果增大气体压强时,不能改变反应气体的浓度,则不影响化学反应速率。 ③. 温度:其他条件不变时,升高温度,能提高反应分子的能量,增加活化分子百分数,从而加快化学反应速率。
④. 催化剂:使用催化剂能等同地改变可逆反应的正、逆化学反应速率。
⑤. 其他因素。如固体反应物的表面积(颗粒大小)、光、不同溶剂、超声波等。
2. 化学平衡:
⑴. 化学平衡研究的对象:可逆反应。
⑵. 化学平衡的概念(略);
⑶. 化学平衡的特征:
动:动态平衡。平衡时v正==v逆 ≠0
等:v正=v逆
定:条件一定,平衡混合物中各组分的百分含量一定(不是相等);
…… …… 余下全文

 ”代替“==”。
”代替“==”。 2H2O;2H2O
2H2O;2H2O 2H2↑+ O2↑
2H2↑+ O2↑
 改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。 断可逆反应达到平衡状态的方法和依据
断可逆反应达到平衡状态的方法和依据
 影响
影响 的结果是化学平衡向反应方程式中化学计量数之和_大_的方向移动。
的结果是化学平衡向反应方程式中化学计量数之和_大_的方向移动。



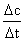 (其中Δc表示某物质浓度的变化量(为正值),若是反应物,表示其浓度的减少(取正值),若是生成物,表示其浓度的增加。常用单位:mol·L-1。Δt为时间的变化。常用单位:s、min、h。
(其中Δc表示某物质浓度的变化量(为正值),若是反应物,表示其浓度的减少(取正值),若是生成物,表示其浓度的增加。常用单位:mol·L-1。Δt为时间的变化。常用单位:s、min、h。