20xx年药物不良反应情况通报
20xx年1—12月份药品不良反应报告情况分以下五个方面:
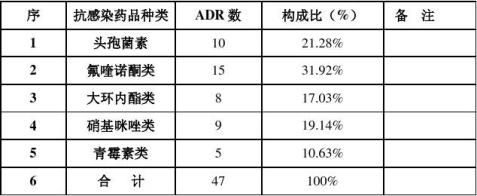
1、上报总数及品种:20xx年1—12月份,我院共上报药监局药品不良反应事件125例,涉及药品54种。其中抗菌药物50例,中药制剂23例,止血药物18例,抗病毒药物10例,其它24例。
2、不良反应发生频率较高的药品分别是:
乳酸左氧氟沙星氯化钠12例,法莫替丁9例,克林霉素针8例,红花针6例,双黄连针5例,乳酸环丙沙星5例,奥硝唑氯化钠4例,维生素k1针4例,头孢哌酮舒巴坦钠4例。
3、不良反应发生的特点:
药物不良反应临床表现主要是胃肠道反应(恶心、呕吐)、过敏反应(皮疹、皮肤发痒)、神经系统反应(发热、寒颤、抽搐)及循环系统反应(头晕、头痛、胸闷)等。本年度未发生特殊的不良反应事件。
4、分析提出引起注意的药品:
抗菌素药品发生的不良反应率最高,滥用抗菌素不仅导致药品不良反应事件和药源性疾病的发生,还易产生对抗菌药物的耐药性,危害极大,应严格掌握其适应症,对发热原因不明者也不宜采用抗菌素,即使使用抗生素,也未必收到预期效果。特别是喹诺酮类药物,乳酸左氧氟沙星氯化钠发生12
例,它的副作用更大,临床上是控制使用的。中药制剂严格控制其输液浓度,更不宜与其它药物混合并用。维生素K1、10%氯化钾针及复方氯化钠除了控制浓度外,也不能静注速度过快,否则易发生心跳过速、面色潮红、血管疼痛等不良反应。望临床各科室使用这些药品时要严格控制,认真审查该药物的说明书,掌握其适应症、用药剂量、用药方法及其它注意事项,详细向病人及家属沟通告知,使病人有心理准备,以避免或者减少药物不良反应事件的发生。
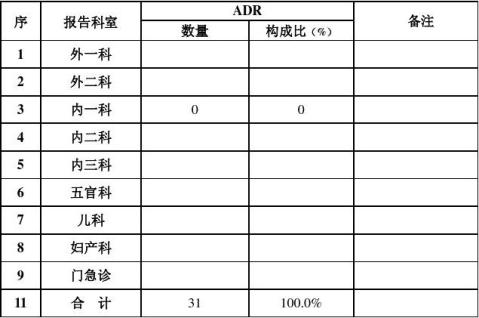
5、科室上报的情况:
全年各科报告例数较多的科室是:普外科总计19例,骨科18例,儿科13例,泌尿外科12例,内分泌科11例,五官科10例,新生儿科9例,心内科9例,内7科8例,说明这些科室对药品不良反应比较重视,应给于表扬,但有个别科室因工作忙等多种原因而发生漏了报现象,整体来看比上一年报告的例数有所提高,还望各科室继续提高对药品不良反应的认识和重视,在工作中严密观察,做到及时发现、及时处置、及时报告,并认真填写药品不良反应报告表,以保证药品不良反应工作顺利开展。
…… …… 余下全文