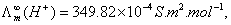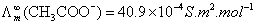定义式:
H=U+pv=U+nRT
G=H-TS=A+pv
A=U-TS
基本公式:
dU=TdS-pdv
dH=TdS+vdp
dA=-SdT-pdv
dG=-SdT+vdp
Maxwell关系式:
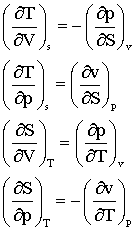
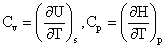 特征函数:
特征函数:
U(S,v);H(S,p);A(T,v);G(T,p);S(U,v)
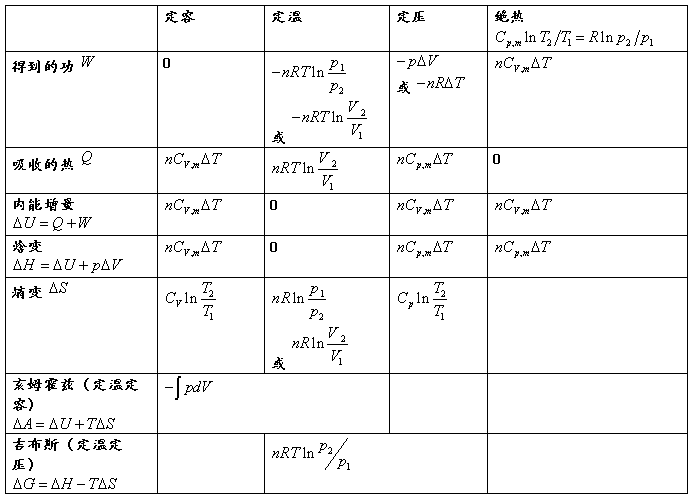
等温可逆过程:
△U=0,△H=0
W=-nRT ln
Q=-W
△A=△G=W
绝热可逆过程:
Q=0,
γ=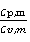 ,Cp,m+Cv,m=nR
,Cp,m+Cv,m=nR
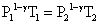
△H=nCp,m(T2-T1)
△U=nC,m(T2-T1)
W=△U
△S=0
△A=△U-S△T
△G=△H-S△T
等外压膨胀:
W=-p△V
△H=nCp,m(T2-T1)
△U=nC,m(T2-T1)
Q=W+△U

△A=△U-△(TS)
△G=△H-△(TS)
多方可逆:
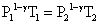
△H=nCp,m(T2-T1)
△U=nCv,,m(T2-T1)

Raoult定律:
pA=pA*xA=pA*(1-xB)
p=pA*xA+pB*xB
Henry定律:
p=kx,BxB
凝固点降低公式:
△Tf=kfmB=
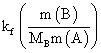
MB=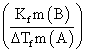
Kirchhiff定律:
△rHm(T)=
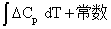
其余公式:
Cp-Cv=nR
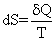
1.可逆热机的效率大于不可逆热机(η≤1)
2.绝热真空(自由)膨胀,自发,△S>0,△A、△G<0,其余都等于0
3.二组分体系最低恒沸点物种数S=2,相态φ=2,独立变量n=0,自由度f=S-φ+n=0
4.保持温度、总压不变,增加惰性气体,效果相当于减压
5.保持温度、总体积不变,增加惰性气体,效果相当于增压
6.平衡常数KpΘ只与温度有关
7.K<1,反应不能自发进行,△G>0;K=1,反应处于平衡状态,△G=0;K>1,反应有可能自发进行,△G<0
…… …… 余下全文


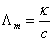






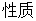

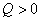 表示环境向系统传热。
表示环境向系统传热。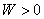 表示环境对系统做功。
表示环境对系统做功。
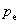 表示环境的压力。
表示环境的压力。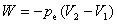
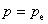 ,p为系统的压力,则有
,p为系统的压力,则有 
 =
=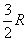


 时,水结成冰的相变过程;
时,水结成冰的相变过程;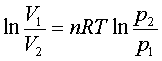
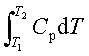
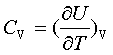 ;
;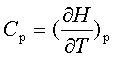
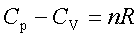
 pedV
pedV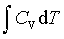 ; ΔH=
; ΔH=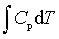
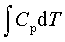 ; ΔU=
; ΔU=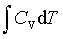
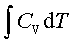 ;ΔH=
;ΔH=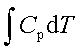
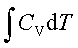 ;ΔH=
;ΔH=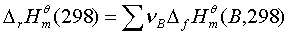
 。
。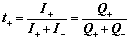
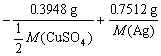
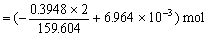 =2.017×10-3 mol
=2.017×10-3 mol 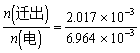 =0.2896
=0.2896 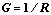 ,电导率
,电导率 ,摩尔电导率:
,摩尔电导率:
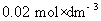 KCl溶液的电导率为0.2768 S·m-1。一电导池中充以此溶液,在25 ℃时测得其电阻为453Ω。在同一电导池中装入同样体积的质量浓度为0.555g.dm-3的CaCl2溶液,测得电阻为1050Ω。计算(1)电导池系数;(2)CaCl2溶液的电导率;(3)CaCl2溶液的摩尔电导率。
KCl溶液的电导率为0.2768 S·m-1。一电导池中充以此溶液,在25 ℃时测得其电阻为453Ω。在同一电导池中装入同样体积的质量浓度为0.555g.dm-3的CaCl2溶液,测得电阻为1050Ω。计算(1)电导池系数;(2)CaCl2溶液的电导率;(3)CaCl2溶液的摩尔电导率。
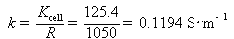
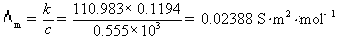

 10-2S.m-1。计算CH3COOH的解离度α及解离常数Kθ。
10-2S.m-1。计算CH3COOH的解离度α及解离常数Kθ。