高中化学有机化学知识点总结
1.需水浴加热的反应有:
(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解
(5)、酚醛树脂的制取(6)固体溶解度的测定
凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
2.需用温度计的实验有:
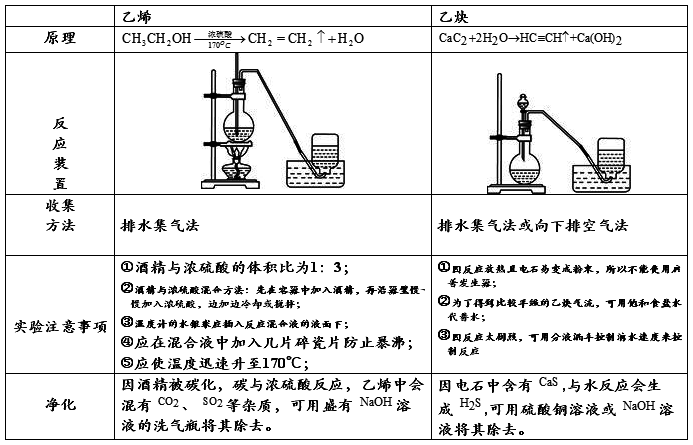
(1)、实验室制乙烯(170℃) (2)、蒸馏 (3)、固体溶解度的测定
(4)、乙酸乙酯的水解(70-80℃) (5)、中和热的测定
(6)制硝基苯(50-60℃)
〔说明〕:(1)凡需要准确控制温度者均需用温度计。(2)注意温度计水银球的位置。
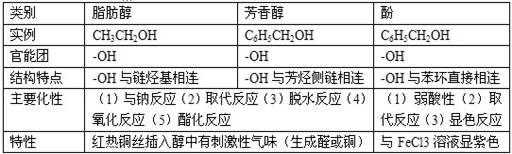
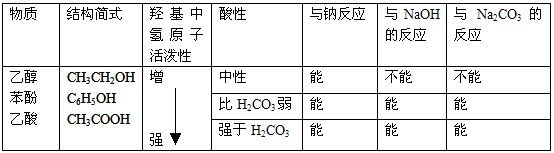
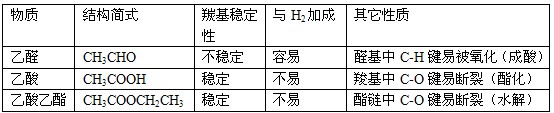
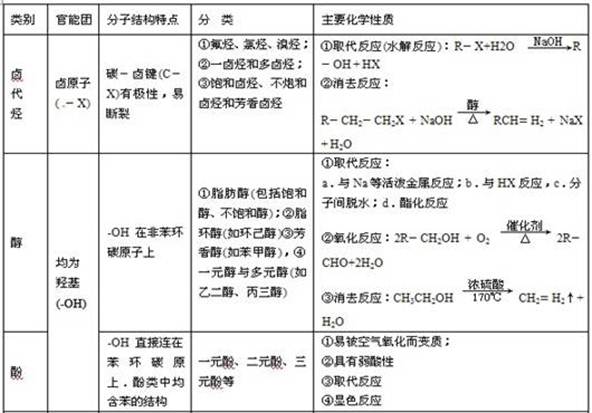
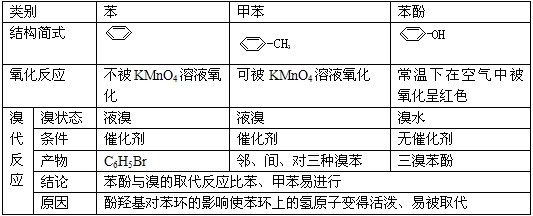
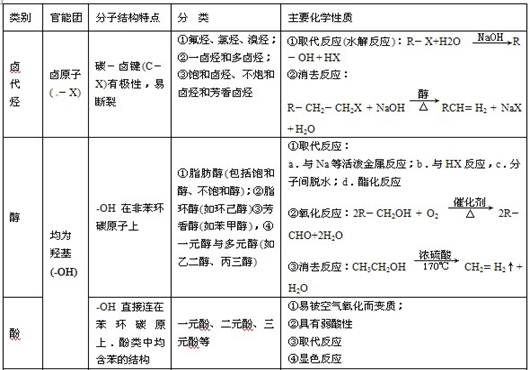
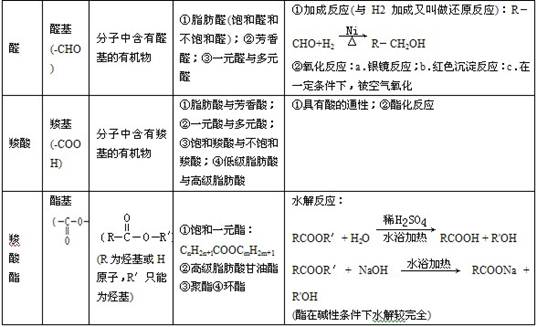
3.能与Na反应的有机物有: 醇、酚、羧酸等——凡含羟基的化合物。
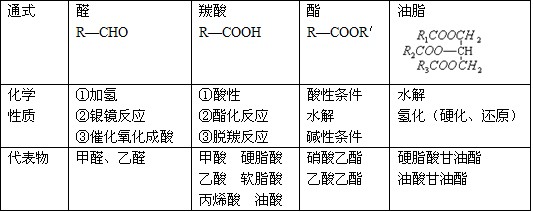
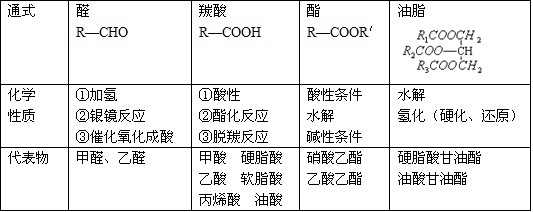
4.能发生银镜反应的物质有:
醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
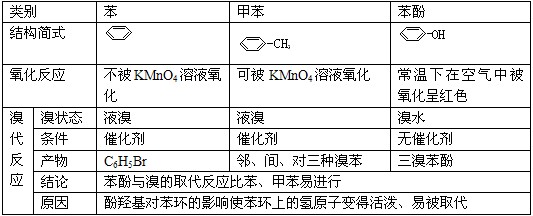
5.能使高锰酸钾酸性溶液褪色的物质有:
(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物
(2)含有羟基的化合物如醇和酚类物质
(3)含有醛基的化合物
(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等)
6.能使溴水褪色的物质有:
(1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成)
(2)苯酚等酚类物质(取代)
(3)含醛基物质(氧化)
(4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应)
(5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化)
(6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。
7.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。
8、密度比水小的液体有机物有:烃、大多数酯、一氯烷烃。
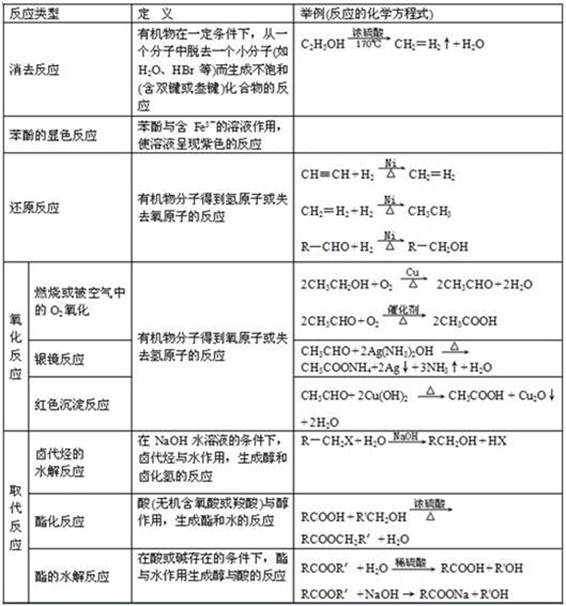
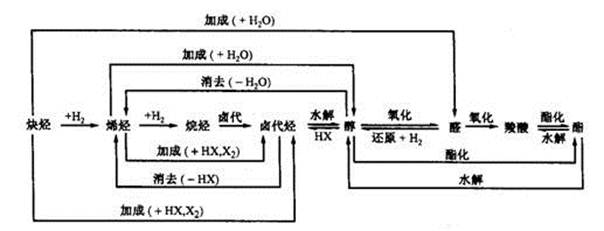
9.能发生水解反应的物质有
卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。
10.不溶于水的有机物有:
烃、卤代烃、酯、淀粉、纤维素
…… …… 余下全文




 +
+

 +
+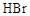
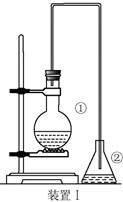
 e.反应完毕可以观察到:在烧瓶底部有褐色不溶于水的液体生成,这是溶解了液溴的粗溴苯,将粗溴苯倒入稀
e.反应完毕可以观察到:在烧瓶底部有褐色不溶于水的液体生成,这是溶解了液溴的粗溴苯,将粗溴苯倒入稀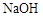 溶液中振荡洗涤,可除去溶解在溴苯中的液溴,得到无色,不溶于水,密度比水大的液态纯溴苯。
溶液中振荡洗涤,可除去溶解在溴苯中的液溴,得到无色,不溶于水,密度比水大的液态纯溴苯。


 +
+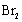
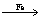
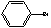 +
+
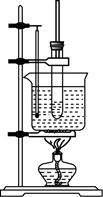 e.反应完毕可以观察到:在烧瓶底部有褐色不溶于水的液体生成,这是溶解了液溴的粗溴苯,将粗溴苯倒入稀
e.反应完毕可以观察到:在烧瓶底部有褐色不溶于水的液体生成,这是溶解了液溴的粗溴苯,将粗溴苯倒入稀 溶液中振荡洗涤,可除去溶解在溴苯中的液溴,得到无色,不溶于水,密度比水大的液态纯溴苯。
溶液中振荡洗涤,可除去溶解在溴苯中的液溴,得到无色,不溶于水,密度比水大的液态纯溴苯。![AC6]3HJ8YC04HQ}1K$1KA3J](https://upload2.fanwen118.com/wk001/2442353/2442353_img_001.jpg)
![3BY)K`2`PC5TH8I459[NL]F](https://upload2.fanwen118.com/wk001/2442353/2442353_img_004.jpg)
![(J)(95ZD%3`_NED]WSLE(1R](https://upload2.fanwen118.com/wk001/2442353/2442353_img_005.jpg)

![6(X3EN)UNMH`BTZ)E@6]]CG](https://upload2.fanwen118.com/wk001/2442353/2442353_img_009.jpg)
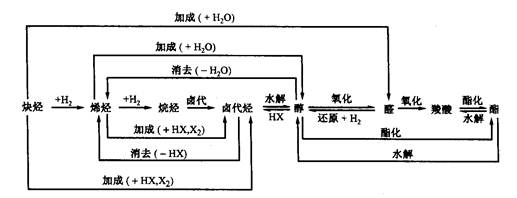
 要作用。
要作用。