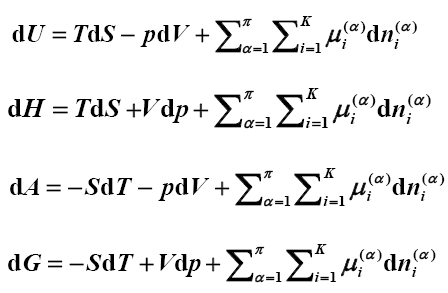《大学化学》的心得体会
阿累尼乌斯说过一句名言:“一切自然科学知识都是从实际生活需要中得出来的。”反过来就是说,学习就是为了生活服务。大学化学教学的目的就是要让学生们掌握科学知识,了解学习的意义,具备认知环境重要的概念,培养高尚的职业情操,以备将来走向社会,为时代的前进和科学的发展尽己所能。大学化学是一门与工程实际结合紧密的基础课程,它涉及的知识点多、面广,可以有效提高学生发现问题、分析问题、解决问题的能力,进一步激发学生的学习兴趣,增进课堂教学互动,提高教学效果,但是在教材的使用过程中仍有一些问题。 《大学化学》将无机化学与定量分析化学两个教学体系的内容融合起来,精简学时、避免内容重复 ,又加强了无机化学与分析化学的联系,使学生从大学一年级开始就建立“定量”的意识,培养学生“量”的概念这一指导思想是正确的。但是,实验教学却产生了由此而来的困难,进入大学后要在没有做过无机实验的情况下立即进行分析实验操作,即在缺乏基本实验技能的基础上先做定量分析实验,无论是对学生还是指导老师都有很大的难度,教学效果受到了影响。第二部分是关于热力学的问题,热力学知识概念抽象,证明与计算涉及微积分知识,教材中相应例题又较为缺乏,给教师布置作业带来困难,学生独立完成课后学题的难度较大。我觉得教师应该增加习题题,通过习题加深对化学热力学的理解,还要认真选择学生的练习题,循序渐进、有层次地逐步深入,对每一类型习题都要较为细致地进行批阅和讲评,使学生在理解原理和相关共识的基础上完成作业,进而较为深入地掌握化学热力学的原理。
在“大学化学”教学中渗透专业知识,化学热力学和化学动力学的理论在其中占有重要地位,如环境科学中的各类环境问题均处于动态平衡或发展之中,化学热力学与化学动力学恰为研究和解决各类环境问题提供理论依据,环境化学、环境微生物、水污染控制等几乎各种环境问题无不充斥着化学热力学与化学动力学的指导作用,体现其在研究解决环境问题中的重要地位。但“大学化学”不可能在教材中突出反映对研究环境问题的指导作用,因此授课教师结合热力学与动力学基本理论介绍专业知识就显得很重要和必要。
…… …… 余下全文