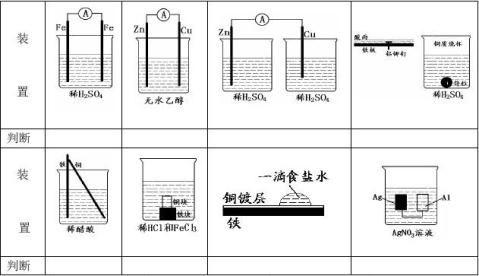
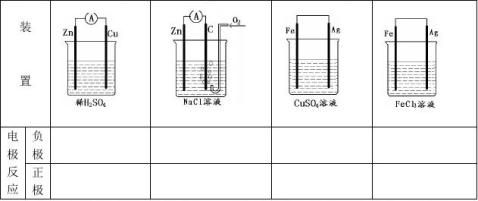
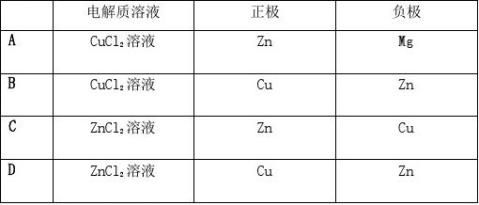
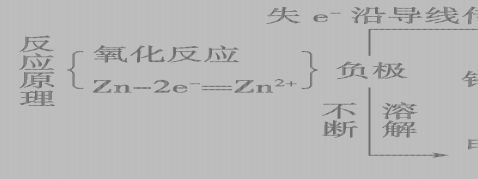高中常见的原电池电极反应式的书写


1、伏打电池:(负极—Zn,正极—Cu,电解液—H2SO4)
-2++-负极: Zn–2e==Zn 正极: 2H+2e==H2↑
总反应离子方程式 Zn + 2H== H2↑+ Zn
2、铁碳电池(析氢腐蚀):(负极—Fe,正极—C,电解液——酸性)
负极: Fe–2e-==Fe2+ 正极:2H++2e-==H2↑
总反应离子方程式 Fe+2H+==H2↑+Fe2+
3、铁碳电池(吸氧腐蚀):(负极—Fe,正极—C,电解液——中性或碱性)
负极: 2Fe–4e-==2Fe2+ 正极:O2+2H2O+4e-==4OH?
总反应化学方程式:2Fe+O2+2H2O==2Fe(OH)2
4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;2Fe(OH)3==Fe2O3 +3 H2O (铁锈的生成过程)
4.铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)
负极: 4Al–12e-==4Al3+ 正极:3O2+6H2O+12e-==12OH?
总反应化学方程式: 4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池)
5、铝–空气–海水(负极--铝,正极--石墨、铂网等能导电的惰性材料,电解液--海水) 负极 :4Al-12e==4Al-+ 2+ 3+ 正极 :3O2+6H2O+12e==12OH --
总反应式为: 4Al+3O2+6H2O===4Al(OH)3 (铂网增大与氧气的接触面)(海洋灯标电池)
6、普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物)
负极:Zn–2e-==Zn2+ 正极:2MnO2+2NH4++2e-==Mn2O3 +2NH3+H2O
总反应化学方程式:Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3+H2O
…… …… 余下全文

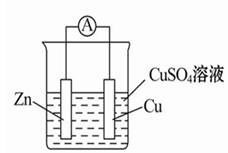
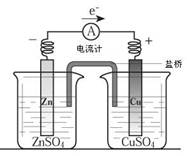

 极反应:以锌铜原电池为例:
极反应:以锌铜原电池为例: 料:一般较活泼金属为负极;或金属为负极,非金属为正极。
料:一般较活泼金属为负极;或金属为负极,非金属为正极。 2)从电子的流动方向 负
2)从电子的流动方向 负 极流入正极
极流入正极