第五单元 化学方程式
课题1 质量守恒定律
考试要求:
认识质量守恒定律,能说明常见化学反应中的质量关系
认识定量研究对化学科学发展的重大作用
考点一、质量守恒定律
1、含义:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
说明:①质量守恒定律只适用于化学变化,不适用于物理变化;
②没有参加反应的物质质量及不是反应生成的物质质量不能计入“总和”中;
③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏。
2、微观解释:在化学反应前后,原子的种类、数目、质量均保持不变(原子的“三不变”)。
3、化学反应前后
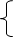 (1)一定不变 宏观:反应物、生成物的总质量不变;元素种类、质量不变 微观:原子的种类、数目、质量不变
(1)一定不变 宏观:反应物、生成物的总质量不变;元素种类、质量不变 微观:原子的种类、数目、质量不变
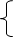 (2)一定改变 宏观:物质的种类一定变
(2)一定改变 宏观:物质的种类一定变
微观:分子种类一定变
(3)可能改变:分子总数可能变
二、化学方程式
1、含义:用化学式表示化学反应的式子。能直接反映质量守恒定律。
2、表示的意义(考点二):⑴表示反应物、生成物和反应条件
⑵表示各物质间的质量比(质量比=各物质的相对分子质量×各化学式前面的系数的积的比)
…… …… 余下全文