盐类的水解
1.复习重点
1.盐类的水解原理及其应用
2.溶液中微粒间的相互关系及守恒原理
2.难点聚焦
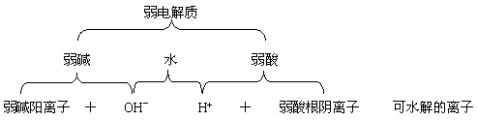
(一) 盐的水解实质
 H2O H++OH—
H2O H++OH—
AB== Bn— + An+
HB(n—1)— A(OH)n
当盐AB能电离出弱酸阴离子(Bn—)或弱碱阳离子(An+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.
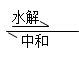 与中和反应的关系:
与中和反应的关系:
盐+水 酸+碱(两者至少有一为弱)
由此可知,盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是完全以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律
简述为:有弱才水解,无弱不水解 越弱越水解,弱弱都水解 谁强显谁性,等强显中性
具体为: 1.正盐溶液
①强酸弱碱盐呈酸性 ②强碱弱酸盐呈碱性
③强酸强碱盐呈中性 ④弱酸碱盐不一定
如 NH4CN CH3CO2NH4 NH4F
…… …… 余下全文


 H2O H++OH—
H2O H++OH— 与中和反应的关系:
与中和反应的关系: H2O H++OH—
H2O H++OH— 与中和反应的关系:
与中和反应的关系: S2—+H2O HS—+OH—(主要)
S2—+H2O HS—+OH—(主要)