本部分知识主要包含:化学键的定义、化学键的比较、原子的电子式、简单阴阳离子的电子式、原子团的电子式、离子化合物的电子式、共价化合物的电子式、离子间的形成、共价键的形成、结构式的书写、极性键与非极性键的比较、分子的极性、键的极性与分子极性的关系等知识。主要的知识点是:
1、使离子或原子相结合的作用力通称为化学键。化学键是强烈的相互作用,所谓“强烈”是指原子间存在电子的转移,即共用电子对的偏移或电子的得失。
2、原子的电子式: 常把其最外层电子数用小黑点“·”或小叉“×”来表示。
4、简单阳离子的电子式:简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子符号表示,如Na+、Li+、Ca2+、Al3+等。
5、原子团的电子式:书写原子团的电子式时,不仅要画出各原子最外层电子数,而且还应用括号“[]”括起来,并在右上角标出“n—”或“n+”电荷字样。
6、离子化合物的电子式:在离子化合物的形成过程中,活泼的金属离子失去电子变成金属阳离子,活泼的非金属离子得到电子变成非金属阴离子,然后阴阳离子通过静电作用结合成离子键,形成离子化合物。所以,离子化合物的电子式是由阳离子和
带中括号的阴离子组成,且简单的阳离子不带最外层电子,而阴离子要标明最外层电子多少。
7、共价化合物的电子式:在共价化合物中,原子之间是通过共用电子对形成的共价键的作用结合在一起的,所以本身没有阴阳离子,因此不会出现阴阳离子和中括号。
8、离子键的形成:原子在参加化学反应时,都有通过得失电子或形成共用电子对使自己的结构变成稳定结构的倾向。
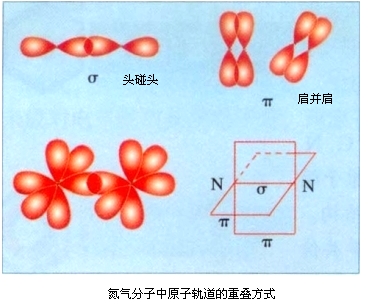
9、共价键的形成:从氯原子和氢原子的结构分析,由于氯和氢都是非金属元素,这两种元素的原子获得电子难易的程度相差不大,原子相互作用的结果是双方各以最外层的一个电子组成一个电子对,电子对为两个原子所共用,在两个原子核外的空间运动,从而使双方最外层都达到稳定结构,这种电子对,就是共用电子对。共用电子对受两个核的共同吸引,使两个原子结合在一起。我们把这种原子间通过共用电子对所形成的相互作用称为共价键。
…… …… 余下全文


 改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。 断可逆反应达到平衡状态的方法和依据
断可逆反应达到平衡状态的方法和依据
 影响
影响 的结果是化学平衡向反应方程式中化学计量数之和_大_的方向移动。
的结果是化学平衡向反应方程式中化学计量数之和_大_的方向移动。