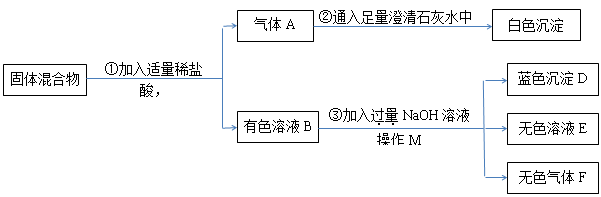
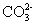离子共存判断规律总结
1、因发生复分解反应而不能大量共存:
(1)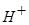 与
与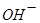 、弱酸的酸式酸根离子不能大量共存;
、弱酸的酸式酸根离子不能大量共存;
(2)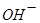 与
与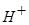 、
、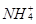 金属活动性顺序表中
金属活动性顺序表中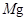 及
及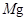 以后的金属离子、酸式酸根离子不能大量共存;
以后的金属离子、酸式酸根离子不能大量共存;
(3)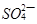 与
与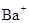 、
、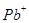 、
、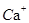 、
、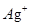 不能大量共存;
不能大量共存;
(4)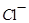 与
与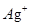 、
、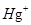 不能大量共存;
不能大量共存;
(5)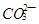 、
、 、
、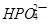 、
、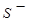 、
、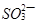 、
、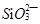 只能与
只能与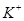 、
、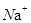 、
、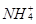 大量共存;
大量共存;
2、因发生氧化还原反应而不能大量共存:
(1)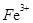 与
与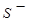 、
、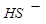 、
、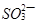 、
、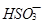 、
、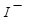 不能大量共存;
不能大量共存;
(2) 、
、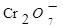 与
与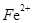 、
、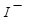 、
、 、
、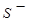 、
、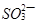 不能大量共存;
不能大量共存;
当 有
有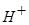 存在时,与
存在时,与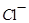 也不能大量共存;
也不能大量共存;
(3)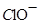 与
与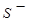 、
、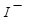 、
、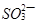 、
、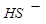 、
、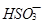 不能大量共存;
不能大量共存;
(4)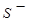 、
、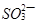 在有
在有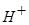 存在时,不能大量共存;
存在时,不能大量共存;
(5)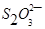 与
与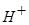 不能大量共存;
不能大量共存;
3、因生成络合物而不能大量共存:
(1)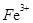 与
与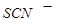 (硫氰根离子)不能大量共存;
(硫氰根离子)不能大量共存;
4、因发生双水解反应而不能大量共存:
(1)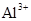 与
与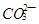 、
、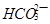 、
、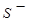 、
、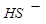 、
、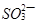 、
、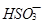 、
、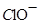 、
、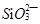 不能大量共存;
不能大量共存;
(2)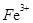 与
与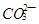 、
、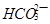 、
、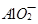 、
、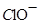 、
、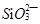 不能大量共存;
不能大量共存;
(3)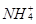 与
与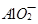 、
、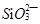 不能大量共存;
不能大量共存;
耿 艳 磊
…… …… 余下全文

 (09) 12.下列离子方程式正确的是
(09) 12.下列离子方程式正确的是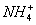 、
、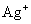 、
、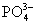 、
、 B.
B.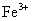 、
、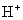 、
、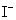 、
、 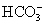
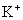 、
、 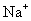 、
、 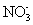 、
、 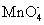 D.
D.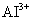 、
、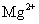 、
、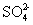 、
、