热力学第二定律
1.热力学第二定律:通过热功转换的限制来研究过程进行的方向和限度。
2.热力学第二定律文字表述:第二类永动机是不可能造成的。(从单一热源吸热使之完全变为功而不留下任何影响。)
3.热力学第二定律的本质:一切自发过程,总的结果都是向混乱度增加的方向进行(a.热与功转换的不可逆性; b.气体混合过程的不可逆性; c.热传导过程的不可逆性)
4.热力学第二定律的数学表达式:Clausius 不等式
5.卡诺循环→热机效率(即:热转化为功的限度有多大?)→卡诺定理(所有工作于同温热源和同温冷源之间的热机,其效率都不能超过可逆机,即可逆机的效率最大。)→从卡诺循环得到结论:热效应与温度商值的加和等于零。→任意可逆循环热温商的加和等于零→熵的引出→熵的变化值可用可逆过程的热温商值来衡量→Clausius 不等式: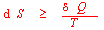 →熵增加原理(熵增加原理)→把与体系密切相关的环境也包括在一起,用来判断过程的自发性(?Siso=?S(体系)+?S(环境)≥0):“>” 号为自发过程;“=” 号为可逆过程)
→熵增加原理(熵增加原理)→把与体系密切相关的环境也包括在一起,用来判断过程的自发性(?Siso=?S(体系)+?S(环境)≥0):“>” 号为自发过程;“=” 号为可逆过程)
 6.等温过程的熵变:(1)理想气体等温变化:?S=nRln(V2/V1)=nRln(P1/P2);(2)等温等压可逆相变(若是不可逆相变,应设计可逆过程): ?S(相变)=?H(相变)/T(相变);(3)理想气体(或理想溶液)的等温混合过程:?S=-R∑nBlnxB
6.等温过程的熵变:(1)理想气体等温变化:?S=nRln(V2/V1)=nRln(P1/P2);(2)等温等压可逆相变(若是不可逆相变,应设计可逆过程): ?S(相变)=?H(相变)/T(相变);(3)理想气体(或理想溶液)的等温混合过程:?S=-R∑nBlnxB
7.变温过程的熵变:(1)等容变温:
 (2)等压变温:
(2)等压变温:
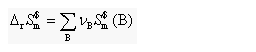
 (3)化学过程的熵变:
(3)化学过程的熵变:
8.标准压力下,求反应温度T时的熵变值:
9.用熵作为判据时,体系必须是孤立体系,也就是说必须同时考虑体系和环境的熵变,这很不方便→有必要引入新的热力学函数,利用体系自身状态函数的变化,来判断自发变化的方向和限度。因此引入新的函数:亥姆霍兹函数A=U-TS与吉布斯函数G=H-TS。
…… …… 余下全文

 可逆或平衡
可逆或平衡 可逆或平衡
可逆或平衡 可逆或平衡
可逆或平衡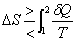 可逆或平衡
可逆或平衡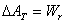
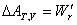

 仲恺农业工程学院
仲恺农业工程学院