必修二化学实验题
实验一:钾与水的反应:
【实验步骤】分别向两只培养皿中加水至其体积的1/2,然后分别加入绿豆大小的一块金属钾和金属钠,注意观察反应的剧烈程度,并记录所发生的现象。

实验结论:
练习1.20##年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
A 单质钠的熔点比钾的熔点低 B 钾与水反应比钠与水反应更剧烈
C 钠和钾都是短周期元素 D 钠和钾的合金[ω(K)=50%-80%]在室温下呈液态
…… …… 余下全文






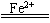 2H2O+O2↑
2H2O+O2↑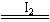 2H2O+O2↑
2H2O+O2↑

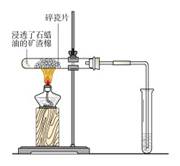 化学方程式:
化学方程式: