1.碳与氧气(不足)的反应2C+O2==== 2CO
碳与氧气(充足)的反应C+O2==== CO2
2.一氧化碳与氧气的反应2CO+O2==== 2CO2
3.二氧化碳与碳的反应CO2+C==== 2CO
4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑
5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑
6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑
7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O
8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH
9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O 碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3+2H2O
10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑
11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑
12.碳酸钙加热的反应CaCO3==== CaO+CO2↑
13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2 二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O
14.氮气与氧气的反应N2+O2==== 2NO
15.一氧化氮与氧气的反应2NO+O2==== 2NO2
16.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO
17.氮气与氢气的反应N2+3H2========= 2NH3
18.氨气与水的反应NH3+H2O==== NH3?H2O
…… …… 余下全文

 2Fe+3Cl2 2FeCl3
2Fe+3Cl2 2FeCl3 Cu+Cl2 CuCl2
Cu+Cl2 CuCl2 H2+Cl2 2HCl
H2+Cl2 2HCl Cl2+H2O HCl+HClO
Cl2+H2O HCl+HClO
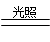 2HclO 2HCl+O2
2HclO 2HCl+O2