
本科学生实验报告[n1]
学号 104120440 姓名 孙永升
学院 生命科学学院 专业、班级 10生物技术
实验课程名称 酶 工 程 < 实验 >
教师及职称 李俊俊 < 讲师 >
开课学期 20## 至 2013 学年 第二学期
填报时间 20## 年 5 月 15 日
云南师范大学教务处编印
…… …… 余下全文

本科学生实验报告[n1]
学号 104120440 姓名 孙永升
学院 生命科学学院 专业、班级 10生物技术
实验课程名称 酶 工 程 < 实验 >
教师及职称 李俊俊 < 讲师 >
开课学期 20## 至 2013 学年 第二学期
填报时间 20## 年 5 月 15 日
云南师范大学教务处编印
…… …… 余下全文
双倒数法测定过氧化物酶的米氏常数
学院/专业/班级____________________________________________ 姓名_______________
合作者___________________________________________________ 教师评定___________
【实验目的】以过氧化物酶为例,掌握测定酶促反应初速率和米氏常数的原理及方法
【实验原理】1913年,Michaelis和Menten运用酶反应过程中形成中间络合物的原理,首先提出了底物浓度和酶促反应速率的关系式,即著名的米氏方程:
 式中:v为反应初速率(微摩尔浓度变化/min);Vmax为最大反应速率(微摩尔浓度变化/min);[S]为底物浓度(mol/L);Km为米氏常数(mol/L)。这个方程式表明当已知Km及Vmax时,酶反应速率与底物浓度之间的定量关系。Km值等于酶促反应速率达到最大反应速率一半时所对应的底物浓度,是酶的特征常数之一。不同酶的Km值不同,同一种酶与不同底物反应Km值也不同,Km值可以近似的反应酶与底物的亲和力大小:Km越大表明亲和力越小;Km越小表明亲和力越大。大多数纯酶的Km值在0.01~100 mmol/L。通过米氏方程的不同变形,可有多种求算米氏常数的方法,一般较常用的双倒数法,即取米氏方程的倒数式:
式中:v为反应初速率(微摩尔浓度变化/min);Vmax为最大反应速率(微摩尔浓度变化/min);[S]为底物浓度(mol/L);Km为米氏常数(mol/L)。这个方程式表明当已知Km及Vmax时,酶反应速率与底物浓度之间的定量关系。Km值等于酶促反应速率达到最大反应速率一半时所对应的底物浓度,是酶的特征常数之一。不同酶的Km值不同,同一种酶与不同底物反应Km值也不同,Km值可以近似的反应酶与底物的亲和力大小:Km越大表明亲和力越小;Km越小表明亲和力越大。大多数纯酶的Km值在0.01~100 mmol/L。通过米氏方程的不同变形,可有多种求算米氏常数的方法,一般较常用的双倒数法,即取米氏方程的倒数式: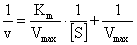 以
以 对
对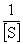 作图得一直线,该直线与横轴截距
作图得一直线,该直线与横轴截距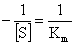 。
。
过氧化物酶是一种对氢受体(H2O2) 底物有特异性,对氢供体底物缺乏特异性的酶,它可催化过氧化氢氧化许多多元酚或多元胺类底物发生显色、荧光或化学发光反应,可用于微量过氧化氢含量测定,也可以和其它酶反应系统偶联可用于测定许多与生命相关的物质:如葡萄糖、半乳糖、氨基酸、尿酸及胆甾醇等,亦是免疫分子和核酸分析中常用的标记物。通常使用的过氧化物酶是从植物辣根中提取的,因此也称为辣根过氧化物酶(horseradish peroxidase, HRP)。HRP属于含血红素蛋白的一种,是由辅基——氯化血红素(铁卟啉)和脱辅基蛋白(糖蛋白)组成,分子量为44000。
…… …… 余下全文
酵母蔗糖酶米氏常数的测定
【目的】
1 . 掌握蔗糖酶米氏常数测定的方法及原理。
2 . 熟悉蔗糖酶米氏常数测定的及意义。
3 . 验证底物浓度对酶促反应速度的影响。
【原理】
当环境温度、 pH 和酶浓度等条件一定时,酶促反应的初速度( V )随底物浓度 [ S ] 增高而加快,直至达到一个极限,即最大反应速度( V max )。依据底物浓度与酶促反应初速度的这种关系,米 – 曼( Michaelis-Menten )氏推倒出如下公式,称为米 – 曼氏方程式(式 3-1 )。方程式中 K m 称为米氏常数, K m 是酶的特征性常数,等于反应速度达到最大反应速度一半时的底物浓度, K m 可以近似地表示酶与底物亲合力的大小, K m 愈小,表明酶与底物的亲合力愈大。测定 K m 是研究酶促反应动力学的一种主要方法。林 – 贝( Lineweaver-Burk )氏将米 – 曼氏方程式等号两边取倒数得到的双倒数方程为林 – 贝氏方程式(式 3-2 )。实验选择不同的 [S] ,测定相对应的 V ,以 1/V 对 1/[S] 作图,得到一个斜率为 K m /V max 的直线,将直线外推与横轴相交,其横轴上截距即﹣ 1/ K m (图 3-7 ),由此求出 K m 。
V = 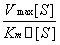 (式 3-1 )
(式 3-1 )
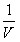 =
= 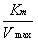 ?
? 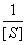 +
+ 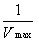 (式 3-2 )
(式 3-2 )
斜率: K m /V max
Y 轴截距: 1/V max
X 轴截距: ﹣ 1/K m

图 3-7 双倒数作图法
本实验以酵母蔗糖酶为例。应用制备的酵母蔗糖酶,在 pH5.0 的醋酸缓冲液中, 30 ℃ 条件下测定其 K m 值。其过程是:当酵母蔗糖酶在有缓冲液存在时与不同浓度的蔗糖混合,保持反应液的温度 30 ℃ ,反应 5min 后,测定还原糖生成量(还原糖的定量测定,参见第 3 篇实验 18 )。以还原糖的生成量代表反应开始阶段的初速度 ( V ) ,按照 Lineweaver–Burk 作图法求得 K m 值。
…… …… 余下全文
碱性磷酸酶米氏常数的测定
【实验目的】通过碱性磷酸酶(alkaline phosphatase,AKP)米氏常数的测定,了解其测定方法和意义。学会运用标准曲线测定酶的活性及观察抑制剂对酶促反应动力学的影响,加深对酶促反应动力学的理解。
【实验原理】本实验以磷酸苯二钠为底物,由碱性磷酸酶催化水解,生成游离酚和磷酸盐。 酚在碱性条件下与4-氨基安替比林作用,经铁氰化钾氧化,生成红色的醌衍生物,颜色深浅和酚的含量成正比。根据吸光值的大小可以计算出酶的活性,也可以从标准曲线上查知酚的含量,进而算出酶活性的大小。
【实验步骤】1. 底物浓度对酶促反应速度的影响
(1) 取6支试管,作好标记。按下表操作:(未加抑制剂组)
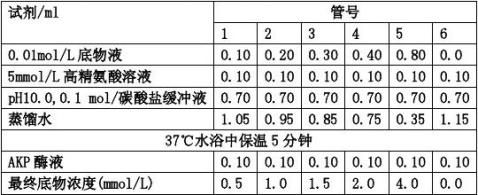
(2) 加入酶液(0.05μg/ml)后,各管混匀并立即记录时间,将上述各管置37℃水浴中准确保
温
15分钟。
(3) 保温结束,立即加碱性溶液1.1 ml终止反应。
(4) 各管分别加入0.3% 4-氨基安替比林1.0 ml,0.5%铁氰化钾2.0 ml,充分混匀,放置
10分钟,以6号空白管作对照,于510 nm波长处比色,根据酚标准曲线计算酶活性。
(5) 以各管基质浓度的倒数1/[S]为横坐标,以各管吸光度值的倒数或者以酶活性单位的倒
数为1/V做横坐标,作图求出Km值。
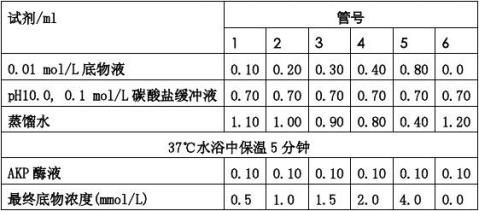
2.酚标准曲线的绘制
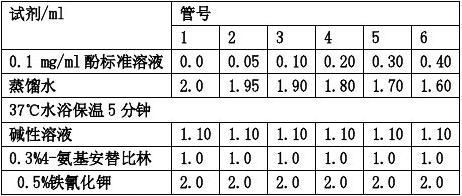
(1) 取洁净干燥试管6支,按下表依次加入试剂:
(2) 混匀后室温放置15分钟,于510 nm波长处比色。
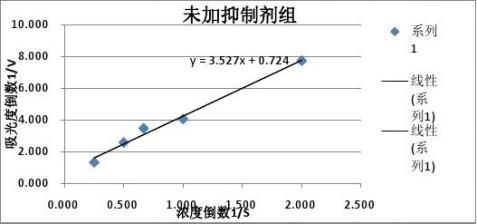
【实验结果与分析】 1.未加抑制剂组
1????
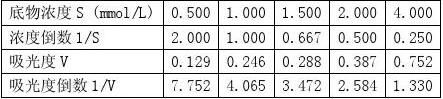
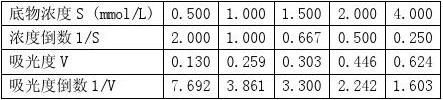
得到拟合直线方程:y=3.5275x+0.7246 根据
1?
=
??????
?+
?
1
可得到:
????=1/0.7246=1.382, ??=????*3.5275=4.871
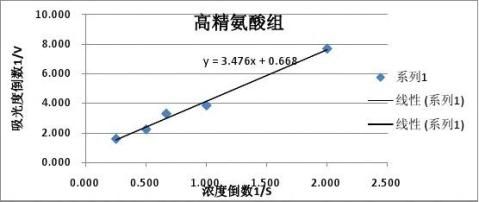
…… …… 余下全文
碱性磷酸酶米氏常数的测定
[目的与要求]
通过碱性磷酸酶米氏常数的测定,了解其测定方法及意义。学会运用标准曲线测定酶的活性,加深对酶促反应动力学的理解。
[原理]
在环境的温度、pH和酶的浓度一定时。酶促反应速度与底物浓度之间的关系表现在反应开始时。酶促反应的速度(V)随底物浓度(S)的增加而迅速增加。若继续增加底物浓度,反应速度的增加率将减少。当底物浓度增加到某种程度时,反应速度会达到一个极限值,即最大反应速度(Vmax),如图37所示。
底物浓度与酶促反应速度的这种关系可用Michaelis-Menten方程式表示。
V = Vmax[S]/(Km+[S])
上式中Vmax为最大反应速度,[S]为底物浓度,Km为米氏常数(Michaelis constant),而其中V则表示反应的起始速度。当V= Vmax/2时,Km =[S]。所以米氏常数是反应速度等于最大反应速度一半时底物的浓度。因此Km的单位以摩尔浓度(mol/L)表示。
Km是酶的最重要的特征性常数,测定Km值是研究酶动力学的一种重要方法,大多数酶的Km值在0.01-100(mmol/L)间。
酶促反应的最大速度Vmax实际上不易准确测定,Km值也就不易准确测出。林-贝 (1ineweaver - Burk)根据Michaelis-Menten方程,推导出如下方程式,即:
1/V = (Km +[S])/ Vmax[S]或1/V = Km/ Vmax·(1/[S])+1/ Vmax
…… …… 余下全文
