实验电离平衡与沉淀平衡
一、实验目的
1.理解弱酸与弱碱的电离平衡移动,认识盐类水解反应及其水解平衡的移动。
2.学会缓冲溶液的配置方法和试验其性质。
3. 掌握沉淀生成、溶解及转化的条件及混合离子的分离方法。
4.掌握离心分离操作和离心机、pH试制的使用。
5. 引导学生准确观察实验现象,善于思考分析,提高实验效果。
二.实验原理
1. 弱电解质在溶液中的电离平衡及其移动
AB(aq) Û A+(aq) + B-(aq)
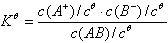 电离常数
电离常数
2.同离子效应
在已建立平衡的弱电解质中,加入与其含有相同离子的另一种强电解质时,会使弱电解质电离度降低的效应称为同离子效应。
3.缓冲溶液
(1) 基本概念:在一定程度上能抵抗外加少量酸、碱或稀释,而保持溶液pH值基本不变的作用称为缓冲作用。具有缓冲作用的溶液称为缓冲溶液。
(2)缓冲溶液组成及计算公式:缓冲溶液一般是由共轭酸碱对组成的,例如弱酸和弱酸盐,或弱碱和弱碱盐。
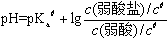 缓冲溶液计算公式
缓冲溶液计算公式
4.盐类的水解
盐类的水解是酸碱中和的逆反应,水解后溶液的酸碱性决定于盐的类型。
5. 难溶电解质的沉淀生成和溶解
根据溶度积规则可以判断沉淀的生成和溶解:
浓度积J > Kspq , 过饱和状态,将有沉淀生成
J = Kspq , 处于动态平衡
J < Kspq , 不饱和状态,无沉淀析出
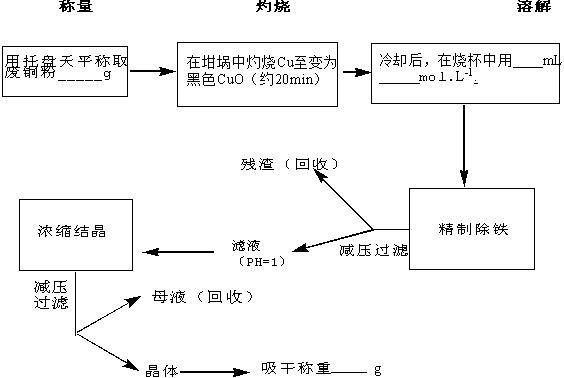
三、实验内容·
1.电离平衡
(1)强电解质和弱电解质
…… …… 余下全文

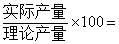 ;
;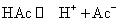
 mAn++nBm-
mAn++nBm-


