篇二 :实验一:一定物质量浓度溶液的配制实验报告
【实验目的】
1.熟练掌握配制一定物质的量浓度的溶液及容量瓶的使用方法;
2.加深对物质的量浓度概念的理解。
【实验内容】
配制0.1mol/L硫酸铜溶液
1. 实验原理
溶液稀释前后溶质的物质的量不变。
2.实验装置图
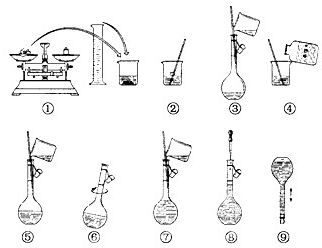
3.实验所需仪器及药品
托盘天平、小烧杯、药匙、容量瓶(250ml)、胶头滴管、玻璃棒、量筒、蒸馏水、CuSO4.5H2O固体
4.实验步骤
(1) 计算:所需固体粉CuSO4.5H2O 固体的质量为:
m(CuSO4.5H2O)=250×10-3×0.1mol/L×250g·mol-1=6.25g
(2)溶解:将固体置于250ml烧杯中,加入约所配溶液体积一半的水溶解,搅拌并冷却到室温。
(3) 转移液体: 将冷却后的溶液沿玻璃棒转移到容量瓶中。
(4)洗涤: 用少量蒸馏水洗涤烧杯2-3次,并将洗涤液也全部转移到容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
(5)定容: 向容量瓶中加水至离刻度1-2cm处,改用胶头滴管加水至刻度线。定容时,溶液凹液面恰好与刻度线相切。
(6)摇匀。
5.注意事项
(1) 在溶解过程中,不能用玻璃棒剧烈搅拌,否则溶液易溅出;
(2) 定容时滴加液体不能超过刻度线,否则实验失败,应倒掉重新配制;
(3)定容时,平视溶液凹液面恰好与刻度线相切。
【参考文献】
人教版化学必修一第一章
…… …… 余下全文
篇三 :一定物质量浓度溶液的配制实验报告
配制一定物质的量浓度的溶液
考试内容:配制100ml0.1mol/LNa2CO3溶液
实验名称:配制100ml0.1mol/LNa2CO3溶液
实验目的:练习配制一定物质的量浓度的溶液;加深对物质的量浓度概念的理解;练习容量瓶的使用方法。
实验原理:溶液稀释前后溶质的物质的量不变。
实验用品:托盘天平、小烧杯、药匙、容量瓶(100ml)、胶头滴管、玻璃棒、量筒、蒸馏水、Na2CO3固体粉末
实验步骤与装置图:
1.计算 所需 Na2CO3固体粉末的质量为:
m(Na2CO3)=100×10-3×0.1mol/L×106g·mol-1=1.06g 因为托盘天平的精确度只能达到0.1,所以应称量1.1g 。
2.称量 称量固体一般应在托盘天平两端各垫一张大小相同的纸。
3.溶解 先将固体置于烧杯中,加入约所配溶液体积一半的水溶解,搅拌并冷却到室温。
4.转移液体 将冷却后的溶液沿玻璃棒转移到容量瓶中。
5.洗涤 用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
6.定容 向容量瓶中加水至离刻度1~2cm处,改用胶头滴管加水至刻度线。定容时,溶液凹液面恰好与刻度线相切。
7.摇匀
①计算;②称量;③溶解;④冷却转移;⑤振荡;⑥定容;⑦摇匀;⑧倒瓶贴签。

实验现象及误差分析:
1.在溶解过程中用玻璃棒搅拌过于剧烈,不慎溅出几滴溶液,会时配成的溶液浓度比标准值偏低。解释:因溅出几滴溶液会使溶液中溶质的物质的量减少,而溶液的体积不变,所以浓度偏低。
2.定容后的溶液从容量瓶导入试剂瓶时,不慎倒在外面少许,不会造成误差。解释:往试剂瓶倒入时不慎倒出少许,影响的仅是所配之溶液的体积,对所配溶液的物质的量浓度无任何影响。
3.定容时不慎滴加液体超过刻度线,则改实验失败,应倒掉重新配制。解释,容量瓶只能配制固定体积的溶液,定容超过刻度线,就意味着实验失败。
…… …… 余下全文
篇四 :无机化学实验第四版实验三:溶液的配制实验报告
实验名称:溶液的配制
实验日期: 温度: 气压:
一. 实验目的
1. 学习比重计,移液管,容量瓶的使用方法
2. 掌握溶液的质量分数,质量摩尔浓度,物质的量浓度等一般配制方法和基本操作
3. 了解特殊溶液的配制
二. 基础知识(详细见课本)
1. 由固体试剂配制溶液
2. 由液体(或浓溶液)试剂配制溶液
三. 基本操作
1. 容量瓶的使用(参见第四章二)
2. 移液管的使用(参见第四章二)
3. 比重计的使用(参见第四章三)
4. 托盘天平及分析天平的使用((参见第四章一)
四. 实验内容(以下的数据供参考)
1. 用硫酸铜晶体粗略配制50ml0.2mol/L的硫酸铜溶液。(涉及粗略配制的知识)
根据前面的计算公式:硫酸铜的质量=CVM=0.2*0.05*160=1.6g
配制过程:用托盘天平称取1.6g的硫酸铜晶体,倒入烧杯,再用量筒量取50ml蒸馏水也倒入烧杯,搅动,使晶体完全溶解,即得50ml0.2mol/L的硫酸铜溶液,将其倒入试剂瓶,贴上标签备用。
2. 准确配制100ml质量分数为0.90%的生理盐水。按氯化钠:氯化钾:氯化钙:碳酸氢钠=45:2.1:1.2:
1的比例,在氯化钠溶液中加入氯化钾,氯化钙,碳酸氢钠,经消毒后即得0.90%的生理盐水。(涉及准确配制的知识)
根据前面的计算公式:溶质的质量=(WV溶剂)/(1-W)
根据比例算出各自所需的质量
配制过程:用分析天平准确称取它们各自的质量,把称取出的氯化钠倒入干净的烧杯中,加入适量的蒸馏水使其完全溶解,再加入氯化钾,氯化钙,碳酸氢钠,搅拌,使它们完全溶解于氯化钠的溶液中,将溶液转移到100/ml的人容量瓶中,用少量蒸馏水洗涤烧杯二至三次,冲洗液也倒入容量瓶中,再加蒸馏水至标线处,盖上塞子,将溶液摇匀,即是所配溶液,经消毒后移入试剂瓶中,贴上标签备用。
…… …… 余下全文
篇五 :化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实 验 报 告
姓名: 班级: 同组人: 自评成绩:
项目: 氢氧化钠标准溶液的配制与标定课程: 学号:
一、实验目的
1. 掌握氢氧化钠溶液的配制和标定方法。
2. 熟悉滴定操作和滴定终点的判断。
3. 学习固定量称量法。
二、实验原理
氢氧化钠滴定液是进行容量分析常用的滴定液,采用间接配制法。由于NaOH极易吸收空气中的水分和CO2,因而市售NaOH常含有Na2CO3。由于Na2CO3的存在对指示剂的使用影响较大,应设法除去。由于Na2CO3在NaOH的饱和溶液中不易溶解,因此,通常将NaOH配成饱和溶液(含量约为52%,相对密度约为1.56),装塑料瓶中放置,待Na2CO3沉淀后,量取一定量上清液,稀释至所需配制的浓度,即得。为消除溶解在水中的CO2的影响,用来配制氢氧化钠滴定液的蒸馏水,应加热煮沸放冷,以除去其中的CO2。邻苯二甲酸氢钾标定氢氧化钠滴定液,滴定反应为:
…… …… 余下全文
篇六 :氯化钠溶液的配置实验报告
实验4:配制100mL1.00 mol/L的NaCl溶液
班级: 姓名:
【实验目的】
1、练习配制一定物质的量浓度的溶液;
2、加深对物质的量浓度概念的理解;
3、练习容量瓶的使用方法
【实验仪器药品】
托盘天平、小烧杯、药匙、100ml容量瓶、胶头滴管、玻璃棒、量筒
【实验药品】
NaCl固体、蒸馏水
【实验步骤】
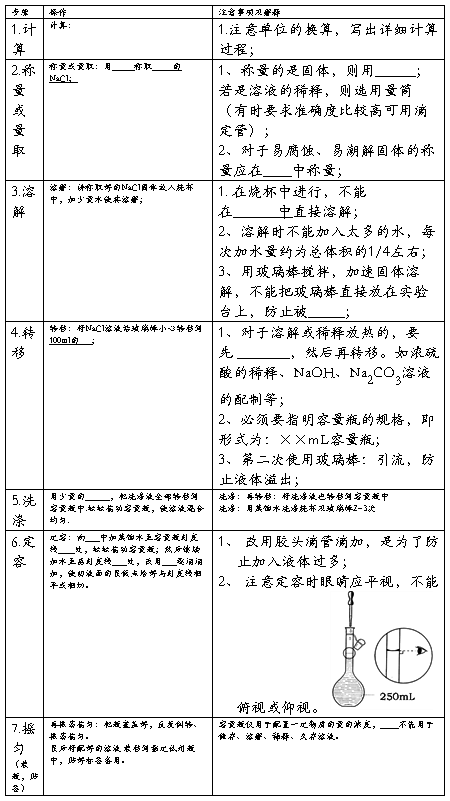
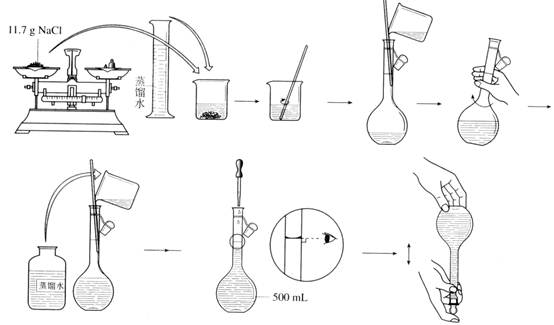
【交流与思考】
1、 容量瓶使用时应注意的事项:
2、 为什么要用蒸馏水来配置溶液而不能用自来水配置呢?
3、 为什么要洗涤玻璃棒和烧杯?如何洗涤?
4、 能否将溶解的NaCl溶液立即注入容量瓶中?为什么?
5、 为什么要将配好的溶液,从容量瓶里倒入试剂瓶?
6、 定容时不慎滴加液体超过刻度线,则该怎么做?
7、 下列实验操作会使所配制的溶液浓度偏高,偏低,还是不变?为什么?
①把溶液向容量瓶中转移,有少量溶液溅出;( ) 原因: ;
②未洗涤烧杯和玻璃棒;( ) 原因: ;
…… …… 余下全文
篇七 :配制一定物质的量浓度的溶液实验报告
配制一定物质的量浓度的溶液实验报告
实验目的
1、练习配制一定物质的量浓度的溶液。
2、加深对物质的量浓度概念的理解。
3、练习容量瓶、胶头滴管的使用方法。
实验原理
n=C V,配制标准浓度的溶液
实验用品
烧杯、容量瓶(100mL)、胶头滴管、量筒、玻璃棒、药匙、滤纸、托盘天平、NaCl(s)、蒸馏水。
实验步骤
(1)计算所需溶质的量
(2)称量:固体用托盘天平,液体用量筒(或滴定管/移液管)移取。
(3)溶解或稀释(用玻璃棒搅拌)
(4)移液:把烧杯液体引流入容量瓶(用玻璃棒引流)。
(5)洗涤:洗涤烧杯和玻璃棒2~3次,洗涤液一并移入容量瓶,振荡摇匀。
(6)定容:向容量瓶中注入蒸馏水至距离刻度线2~3 cm处改用胶头滴管滴蒸馏水至溶液凹液面与刻度线正好相切。(要求平视)
(7)盖好瓶塞,反复上下颠倒,摇匀。
实验结果
计算出溶质的质量
实验结论
(1)配制一定物质的量浓度的溶液是将一定质量或体积的溶质按所配溶液的体积在选定的容量瓶中定容,因而不需要计算水的用量。
(2)不能配制任意体积的一定物质的量浓度的溶液。这是因为在配制的过程中是用容量瓶来定容的,而容量瓶的规格又是有限的,常用的有50 mL、100 mL、250 mL、500 mL、和1000 mL等。所以只能配制体积与容量瓶容积相同的一定物质的量浓度的溶液。
备注
重点注意事项:
(1)容量瓶使用之前一定要检查瓶塞是否漏水;
(2)配制一定体积的溶液时,容量瓶的规格必须与要配制的溶液的体积相同;
(3)不能把溶质直接放入容量瓶中溶解或稀释;
(4)溶解时放热的必须冷却至室温后才能移液;
(5)定容后,经反复颠倒,摇匀后会出现容量瓶中的液面低于容量瓶刻度线的情况,这时不能再向容量瓶中加入蒸馏水。因为定容后液体的体积刚好为容量瓶标定容积。上述情况的出现主要是部分溶液在润湿容量瓶磨口时有所损失;
…… …… 余下全文
篇八 :实验报告_酸碱标准溶液的配制和标定
实验一酸碱标准溶液的配制和标定
实验目的
1. 掌握标准溶液的配制方法。
2. 掌握滴定法定量测定溶液浓度的原理,熟悉滴定管、移液管的准备、使用及滴定操作。
3. 熟悉甲基橙和酚酞指示剂的使用和终点的确定。
实验原理
酸碱滴定法是化学定量分析中最基本的分析方法。一般能与酸或碱直接(或间接)发生酸碱反应的物质大多可用酸碱滴定法测定他们的浓度。
按酸碱反应方程式中的化学计量系数之比,酸与碱完全中和时的pH值称为化学计量点,达到化学计量点时,应满足如下基本关系:
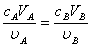
式中,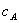 、
、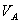 、
、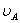 分别为酸的“物质的量”浓度、体积、化学计量系数;
分别为酸的“物质的量”浓度、体积、化学计量系数;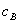 、
、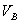 、
、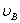 分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的化学计量系数由酸碱反应方程式决定。
分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的化学计量系数由酸碱反应方程式决定。
由于酸、碱的强弱程度不同,因此酸碱滴定的化学计量点不一定在pH=7处。通常,酸碱溶液为无色,酸碱中和是否完全,需用指示剂的变色来判断。指示剂往往是一些有机的弱酸或弱碱,它们在不同pH值条件下颜色不同。用作指示剂时,其变色点(在化学计量点附近)的pH值称为滴定终点。选用指示剂要注意:①变色点与化学计量点尽量一致;②颜色变化明显;③指示剂用量适当。
酸碱滴定中常用HCl和NaOH溶液作为标准溶液,但由于浓HCl容易挥发,NaOH固体容易吸收空气中的H2O和CO2,直接配成的溶液其浓度不能达到标准溶液的精度,只能用标定法加以标定。基准物质H2C2O4的分子式确定,化学性质稳定,不易脱水或吸水,可以准确称量,所以,本实验采用(H2C2O4·2H2O,摩尔质量为126.07g·mol-1) 为基准物质,配成H2C2O4标准溶液。以酚酞为指示剂,用H2C2O4标准溶液标定NaOH溶液;再以甲基橙为指示剂,用标定后的NaOH标准溶液滴定HCl溶液,从而得到HCl标准溶液。
…… …… 余下全文

推荐阅读
猜你喜欢
