实验一 缓冲溶液的配制和性质、溶液pH值测定
【实验目的】
1. 学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法。
2. 加深对缓冲溶液性质的理解。
3. 强化吸量管的使用方法。
4. 学习使用pHS-2C型酸度计。
5. 培养环境保护意识。
【预习作业】
1. 一般性溶液与缓冲溶液有什么不同?
2. 缓冲溶液的性质有哪些?
3. 如何衡量缓冲溶液的缓冲能力大小?缓冲溶液的缓冲能力与什么因素有关?
4. 实验是如何设计以验证缓冲溶液所具有的性质及缓冲容量的影响因素的,设计时有哪些注意事项?
5. 该如何检测缓冲溶液的pH值是否发生改变?是否均需要用pH计?
…… …… 余下全文

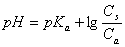 或
或 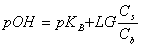
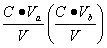 ,盐的浓度为
,盐的浓度为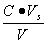 ,则
,则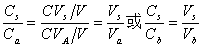
 或
或 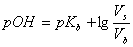
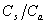 (或
(或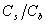 )=1,酸(或碱)、盐浓度大的,缓冲容量亦大。但实践中酸(或碱)、盐浓度不宜过大。
)=1,酸(或碱)、盐浓度大的,缓冲容量亦大。但实践中酸(或碱)、盐浓度不宜过大。


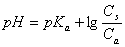 或
或 
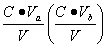 ,盐的浓度为
,盐的浓度为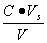 ,则
,则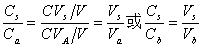
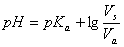 或
或 
 (或
(或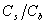 )=1,酸(或碱)、盐浓度大的,缓冲容量亦大。但实践中酸(或碱)、盐浓度不宜过大。
)=1,酸(或碱)、盐浓度大的,缓冲容量亦大。但实践中酸(或碱)、盐浓度不宜过大。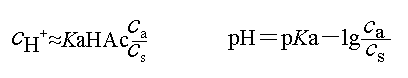
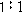 时,缓冲容量最大。
时,缓冲容量最大。