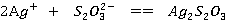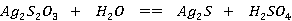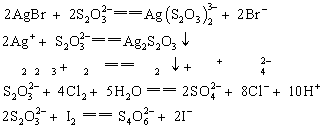硫代硫酸钠的制备
班级:化工12-2 姓名:茆邦宇 学号:12014280327
摘要:实验目的在于提升同学对于硫代硫酸钠制备方法的了解;进一步熟悉蒸发浓缩、减压过滤、结晶等相关基本操作。采用亚硫酸钠法。用近饱和的亚硫酸钠溶液和硫粉,共煮来制备硫代硫酸钠。由于硫代硫酸钠具有不稳定性,较强的还原性和配位能力。所以对制好的产品进行性质鉴定。用硝酸银溶液检测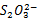 ,用盐酸溶液检验其不稳定性,用碘水检验其还原性,用溴化钾和硝酸银混合溶液检验其配合性。
,用盐酸溶液检验其不稳定性,用碘水检验其还原性,用溴化钾和硝酸银混合溶液检验其配合性。
关键词:硫代硫酸钠 不稳定性 还原性 配合性
前言:硫代硫酸钠是最重要的硫代硫酸盐,俗称“海波”,又名“大苏打”,是无色透明单斜晶体。易溶于水,难溶于乙醇,硫代硫酸钠在酸性条件下极不稳定,易分解;硫代硫酸钠具有较强的还原性和配位能力,可用于照相行业的定影剂,洗染业、造纸业的脱氯剂。定量分析中的还原剂。
【实验部分】
1.1仪器及试剂:
仪器:电热套;100ml烧杯;10ml量筒;蒸发皿;玻璃棒;石棉网;点滴板;抽滤瓶;布氏漏斗。
试剂:6g 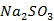 固体;1.5g硫粉;3ml乙醇溶液;活性炭;0.1mol/L
固体;1.5g硫粉;3ml乙醇溶液;活性炭;0.1mol/L 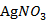 溶液;碘水;蓝色石蕊试纸;6mol/L 盐酸溶液;0.1mol/L KBr溶液。
溶液;碘水;蓝色石蕊试纸;6mol/L 盐酸溶液;0.1mol/L KBr溶液。
1.2实验原理:
亚硫酸钠溶液与硫粉共煮,反应如下:

反应液经脱色、过滤、浓缩结晶、。过滤、干燥即得产品。
1.3实验步骤:
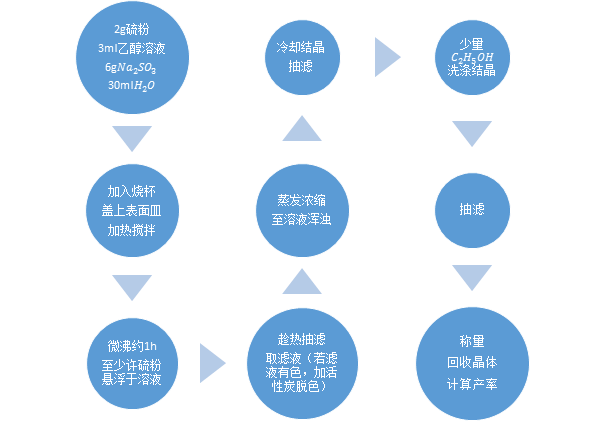
2.1硫代硫酸钠的性质实验:
a. 离子的鉴定
离子的鉴定
在点滴板加入2滴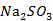 溶液再加2滴0.1mol/L
溶液再加2滴0.1mol/L 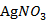 溶液,观察现象。
溶液,观察现象。
现象:沉淀由白色变黄变棕,最后变为黑色。
反应方程式: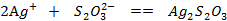
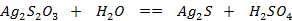
b.不稳定性
…… …… 余下全文

 ,用盐酸溶液检验其不稳定性,用碘水检验其还原性,用溴化钾和硝酸银混合溶液检验其配合性。
,用盐酸溶液检验其不稳定性,用碘水检验其还原性,用溴化钾和硝酸银混合溶液检验其配合性。 固体;1.5g硫粉;3ml乙醇溶液;活性炭;0.1mol/L
固体;1.5g硫粉;3ml乙醇溶液;活性炭;0.1mol/L 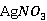 溶液;碘水;蓝色石蕊试纸;6mol/L 盐酸溶液;0.1mol/L KBr溶液。
溶液;碘水;蓝色石蕊试纸;6mol/L 盐酸溶液;0.1mol/L KBr溶液。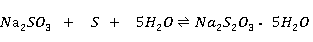

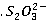 离子的鉴定
离子的鉴定 溶液再加2滴0.1mol/L
溶液再加2滴0.1mol/L