二、 实验步骤
(一)同离子效应
1、取两只小试管,0.1mol/LHAc溶液及1滴甲基橙,混合均匀,溶液呈红色。在一试管中加入少量NaAc(s),观察指示剂颜色变化 指示剂变黄。
HA c = H+ + Ac-
NaAc = Na+ + Ac—
2、取两只小试管,各加入5滴0.1mol/LMgCl2溶液,在其中以支试管中再加入5滴饱和NH4Cl溶液,然后分别在这两支试管中加入5滴2mol/LNH3·H2O,观察两试管发生的现象有何不同?何故?
MgCl2 = Mg2+ + 2Cl-
Mg2+ + 2OH— = Mg(OH)2↓
NH4Cl解离出的Cl-使 MgCl2解离平衡向左移动减小了溶液中Mg2+的浓度,因而在入5滴饱和NH4Cl溶液,然后在这支试管中加入5滴2mol/LNH3·H2O无白色沉淀生成。
(二)缓冲溶液的配制
1、用1mol/LHAc溶液和1mol/LNaAc溶液配置pH=4.0的缓冲溶液10mL.应该如何配制?配好后,用pH试纸测定其pH值,检验其是否符合要求.
PH = pKa + lgCAc-/CHAc
4 = 4.75 + lgCAc-/CHAc
lgCAc-/CHAc = -0.75
CAc-/CHAc =0.178
V Ac-/10-VHAc =0.178
V Ac- = 1.51 mL
VHAc =8.59mL
2、将上述缓冲溶液分成两等份,在一分中加入1mol/LHCl溶液1滴,在另一分中加入1mol/LnaOH溶液,分别测定其pH值。
3、取两只试管,各加入5毫升蒸馏水,用pH试纸测定其pH值。然后分别加入1mol/LHCl1滴和1mol/LnaOH1滴,再用pH试纸测定其pH值。与“2”进行比较。
(三)盐的水解
1、 在三只小试管中分别加入1毫升0.1mol/LNa2CO3,NaCl,及Al2(SO4)3溶液,用pH试纸测定它们的酸碱性。解释其原因,并写出有关反应程式。
…… …… 余下全文


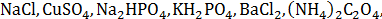

 NH4++OH-,当增大溶液的pH时,c(NH4+)会( )
NH4++OH-,当增大溶液的pH时,c(NH4+)会( )
 1、电导G:对于电解质溶液,常用电导表示其导电能力的大小。电导G是电阻R的倒数,即 G=1/R。电导的单位是西门子,常用S表示。1S=1Ω-1
1、电导G:对于电解质溶液,常用电导表示其导电能力的大小。电导G是电阻R的倒数,即 G=1/R。电导的单位是西门子,常用S表示。1S=1Ω-1 (2.5.3)
(2.5.3)