实验名称:置换法测定镁的摩尔质量
实验日期: 温度: 气压:
一、实验目的
1.了解置换法测定镁的相对原子质量的原理和方法
2.掌握气态方程和分压定律的有关的计算
3.练习使用量气管和气压计
二、实验原理
1.在一定的温度T和压力P下,一定质量m的镁与足量的稀硫酸反应,可置换出一定体积y的氢气(含水蒸汽) Mg+H2SO4===MgSO4+H2
常压下的氢气可近似看作理想气体,根据气体状态方程和化学方程式,则有:
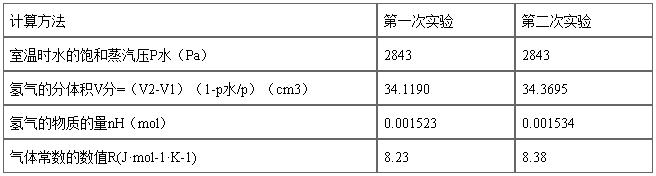
PH2V=nH2RT=(m/M)RT R为常数 R=8.314 R的单位Pa*m3/mol*K T=(t+273)K
根据分压定律:PH2=P-PH2O,(我们所需的是氢气的压力,但是我们不能直接得到,所以我们通过大气的压力减去水蒸汽的压力便是我们想得到的氢气压力)
整理后可得:M=mRT/[(P-PH2O)]V
三、实验内容
1.用砂纸将镁条打光,清除掉表面氧化物膜,截取一段,在电子天平上准确称其质量。
2.装配好仪器,由漏斗注水至近于量气管刻度“0”的位置,上下移动漏斗以驱赶量气管与橡皮管内的气泡。
3.检查装置是否漏气,将各连接处的橡皮塞塞紧,把漏斗下移适当的距离固定,如果连气管内的液面只在开始时稍有下降,以后维持恒定,经3至5分钟不变,可判断装置不漏气。
4.将漏斗上移至原处,取下试管,用另外的漏斗向试管中注入c(H2SO4)=2mol/L溶液5mL(切勿使酸沾在试管内壁上)用一滴水将镁条沾在试管内壁上部,前确保镁条不与酸接触,将试管倾斜固定在铁架台上,塞紧橡皮塞,再一次检查装置是否漏气。(根据连通器的原理检查装置是否漏气)
5.将漏斗移至量气管近右侧,使两面处于同一水平面,几下量气管液面刻度。
6.将试管直立,使镁条落入酸中,而后将试管按原样固定,同时移动漏斗,是量气管与漏斗液面始终大体保持一致。
7.镁条反应完后,待试管冷至室温(约经十几分钟,也可用冷水在试管外冷却),将漏斗移至量气管近右侧,使两者处于同一水平,记下液面位置,稍等1至2分钟,再记下液面位置,若两次读数相等,即表示管内温度与室温一致。
…… …… 余下全文
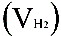 ,有理想气体状态方程式即可算出摩尔气体常数 R. R=
,有理想气体状态方程式即可算出摩尔气体常数 R. R=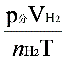 (
(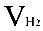 为氢气的分体积,
为氢气的分体积,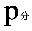 为氢气的分压强,
为氢气的分压强, 为氢气的摩尔质量,T为温度)
为氢气的摩尔质量,T为温度)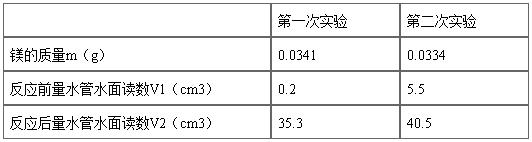
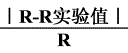

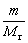 RT (1)
RT (1) ,求
,求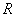 。反应
。反应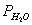 。根据分压定律
。根据分压定律  ,则
,则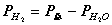
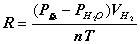
 气体常数R的测定
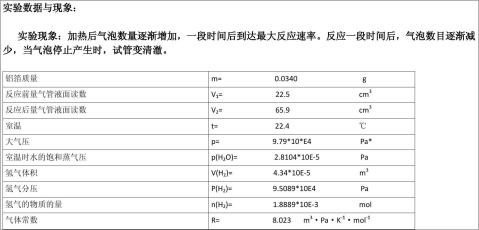
气体常数R的测定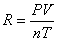 。因此对一定量的气体,若在一定温度、压力条件下测出其体积就可求出R,本实验是测定铝与稀盐酸反应产生的氢气的体积。
。因此对一定量的气体,若在一定温度、压力条件下测出其体积就可求出R,本实验是测定铝与稀盐酸反应产生的氢气的体积。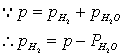
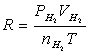
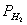 、
、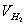 、
、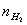 、T等就可利用公式求出R。
、T等就可利用公式求出R。 1. 用砂纸擦去镁条表面氧化膜,取两片35-45mg镁条分别在电子分析天平上准确称量;
1. 用砂纸擦去镁条表面氧化膜,取两片35-45mg镁条分别在电子分析天平上准确称量;