山东轻工业学院实验报告
成绩
课程名称 基础化学实验1 指导教师 周磊 实验日期
院(系) 专业班级 实验地点 实验楼A座412
学生姓名 学号 同组人
…… …… 余下全文
物理化学实验报告
姓名:何思思
班级:工艺五班
学号:10031010526
教师:李慎新
学院:材料化学与工程学院
电导法测定乙酸电离平衡常数
一、 实验目的
1、 掌握电导、电导率、摩尔电导率的概念以及他们之间的联系。
2、 掌握由电导法测定弱电解质电离平衡常熟的原理。
二、 实验原理
1、 电离平衡常数Kc的测定原理:
α=∧m/∧m∞
CH3COOH —→ CH3COO- + H
开始 C 0 0
平衡 C(1-α) Cα Cα
Kc= Cα²/(1-α)=C∧m²/∧m∞(∧m∞-∧m)
则:C·∧m=(∧m∞·Kc/∧m)- (∧m∞·Kc)
2、 摩尔电导率 的测定原理:
∧m=κ/C G=κA/l κ=l/A·G=Kcell·G
G:电阻的倒数 κ:电阻率的倒数
3、不同温度下醋酸的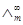 (S·m2·mol-1)
(S·m2·mol-1)
…… …… 余下全文
实验四 醋酸解离常数的测定
(一) pH法
一. 实验目的
1. 学习溶液的配制方法及有关仪器的使用
2. 学习醋酸解离常数的测定方法
3. 学习酸度计的使用方法
二. 实验原理
醋酸(CH3COOH,简写为HAc)是一元弱酸,在水溶液中存在如下解离平衡:
HAc(aq) + H2O(l) D H3O+(aq) + Ac- (aq)
其解离常数的表达式为
[c (H3O+)/cθ][c(Ac-)/ cθ]
Kθa HAc(aq) = —————————————
c(HAc)/ cθ
…… …… 余下全文
实验六 电导法测定乙酸电离平衡常数
报告人:曾辉 实验时间20##年03月07日
一.实验目的:
1.掌握电导、电导率、摩尔电导率的概念以及它们之间的相互关系。
3.掌握电导法测定弱电解质电离平衡常数的原理。
二.实验原理:
1.电离平衡常数Kc的测定原理
在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务。在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为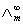 ,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率
,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率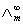 是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
 (1)
(1)
式中为弱电解质的电离度。
对AB型弱电解质,如乙酸(即醋酸),在溶液中电离达到平衡时,其电离平衡常数Kc与浓度c和电离度α的关系推导如下:
CH3COOH →CH3COO- + H+
起始浓度 c 0 0
…… …… 余下全文
实验名称:醋酸解离和解离常数的测定——pH计的使用
实验日期: 温度: 气压:
一、实验目的
1.测定醋酸的解离度和解离常数
2.掌握滴定原理,滴定操作及正确判断滴定终点
3.学习使用pH计
二、实验原理(详见课本P139)
三、基本操作
1.滴定管的使用,参见第四章二
2.移液管,吸量管的使用,参见第四章二
3.容量瓶的使用,参加第四章二
4.pH计的使用,参见第七章一
四、实验内容
1.醋酸溶液浓度的测定
以酚酞为指示液,用已知浓度的氢氧化钠标准溶液标定HAc溶液的标准浓度,把结果填入下表。

2.配制不同浓度的HAc溶液
用移液管和吸量管分别取25.00ml,5.00ml,2.50ml已测定得准确浓度的HAc溶液,把它们分别加入三个50ml容量瓶中,再用蒸馏水稀释至刻度,摇匀,并计算出这三个容量瓶中HAc溶液的准确浓度。(数据仅供参考)
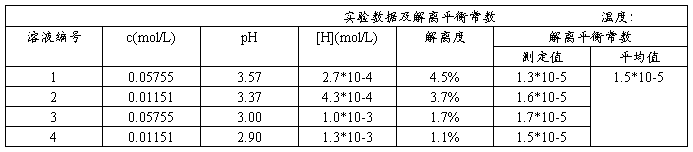
3.测定醋酸溶液的pH,计算醋酸的解离度和解离平衡常数
把以上四种不同浓度的HAc溶液分别加入四只洁净干燥的50ml烧杯中,按稀到浓的次序在pH计上分别测定它们的pH,并将有关数据填入表中:

五、实验习题
1.以氢氧化钠标准装入碱式滴定管中滴定待测HAc溶液,以下情况对滴定结果有何影响?
1) 滴定过程中滴定管下端产生了气泡;偏小
2) 滴定近终点时,没有用用蒸馏水冲洗瓶的内壁;偏大
…… …… 余下全文
实验一 电导法测定醋酸电离常数
一、实验目的
1.了解溶液电导、电导率和摩尔电导率的概念;
2.测量电解质溶液的摩尔电导率,并计算弱电解质溶液的电离常数。
二、实验原理
电解质溶液是靠正、负离子的迁移来传递电流。而弱电解质溶液中,只有已电离部分才能承担传递电量的任务。在无限稀释的溶液中可以认为电解质已全部电离,此时溶液的摩尔电导率为Λ∞m,而且可用离子极限摩尔电导率相加而得。
一定浓度下的摩尔电导率Λm与无限稀释的溶液中摩尔电导率Λ∞m是有差别的。这由两个因素造成,一是电解质溶液的不完全离解,二是离子间存在着相互作用力。所以,Λm通常称为表观摩尔电导率。
Λm/Λ∞m=α(U++ U-)/(U+∞+ U-∞)
若U+= U-,,U+∞=U-∞则
Λm/Λ∞m=α
式中α为电离度。
 AB型弱电解质在溶液中电离达到平衡时,电离平衡常数Ka?,起始浓度C0,电离度α有以下关系: AB A+ + B-
AB型弱电解质在溶液中电离达到平衡时,电离平衡常数Ka?,起始浓度C0,电离度α有以下关系: AB A+ + B-
起始浓度mol/L: C0 0 0
平衡浓度mol/L: C0·(1-α) αC0 αC0
…… …… 余下全文
实验六 醋酸电离度和电离常数的测定—pH法
一、实验目的
1.测定醋酸的电离度和电离常数;
2.学习pH计的使用。
[教学重点]
醋酸的电离度、电离常数的测定
[教学难点]
pH计的使用
[实验用品]
仪器:滴定管、吸量管(5mL)、容量瓶(50 mL)、pH计、玻璃电极、甘汞电极
药品:0.200 mol·L-1HAc标准溶液、0.200 mol·L-1NaOH标准溶液、酚酞指示剂、标准缓冲溶液(pH=6.86、pH=4.00)
二、基本原理
HAc → H++ Ac-
C:HAc的起始浓度;[H+]、[Ac-]、[HAc]:分别为平衡浓度;
α:电离数;K:平衡常数
α =  × 100%
× 100%
Ka = 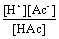 =
= 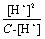
当α小于5时,C - [H+]≈C,所以Ka≈ 
根据以上关系,通过测定已知浓度HAc溶液的pH值,就可算出[H+],从而可以计算该HAc溶液的电离度和平衡常数。(pH=-lg[H+],[H+]=10-pH)
三、实验内容
1.HAc溶液浓度的测定(碱式滴定管)
以酚酞为指示剂,用已知浓度的NaOH溶液测定HAc的浓度。

2.配制不同浓度的HAc溶液
用移液管或吸量管分别取2.50 mL、5.00 mL、25.00 mL已测得准确浓度的HAc溶液,分别加入3只50 mL容量瓶中,用去离子水稀释至刻度,摇匀,并计算出三个容量瓶中HAc溶液的准确浓度。将溶液从稀到浓排序编号为:1、2、3,原溶液为4号。
3.测定HAc溶液的pH值,并计算HAc的电离度、电离常数
把以上四种不同浓度的HAc溶液分别加入四只洁净干燥的50 L杯中,按由稀到浓的顺序在pH计上分别测定它们的pH值,并记录数据和室温。将数据填入下表(p.129.),计算HAc电离度和电离常数。
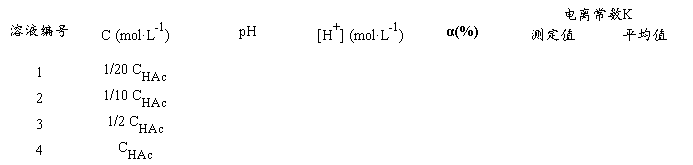
K值在1.0×10-5~2.0×10-5范围内合格(文献值25℃1.76×10-5)
…… …… 余下全文
实验三 醋酸电离度和电离平衡常数的测定
一、实验目的
1.测定醋酸的电离度和电离平衡常数。
2.学会正确地使用pH计。
3.练习和巩固容量瓶、移液管、滴定管等仪器的基本操作。
二、实验原理
醋酸CH3COOH(简写为HAc)是一元弱酸,在溶液中存在下列电离平衡:

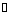
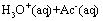
忽略水的电离,其电离常数:

首先,一元弱酸的浓度是已知的,其次在一定温度下,通过测定弱酸的pH值,由pH = -lg[H3O+], 可计算出其中的[H3O+]。对于一元弱酸,当c/Ka ≥500时,存在下列关系式:

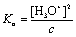
由此可计算出醋酸在不同浓度时的解离度(a)和醋酸的电离平衡常数( )。
)。
或者也可由 计算出弱酸的解离常数(
计算出弱酸的解离常数( )。
)。
三、仪器和试药
仪器:移液管、吸量管、容量瓶、碱式滴定管、锥形瓶、烧杯、量筒、pHS-3C型酸度计。
试药:冰醋酸(或醋酸)、NaOH标准溶液(0.1mol·L-1)、标准缓冲溶液(pH = 6.86, 4.00) 酚酞溶液(1%)。
四、实验内容
1.配置250mL浓度为0.1mol·L-1的醋酸溶液
用量筒量取4mL 36%(约6.2 mol·L-1)的醋酸溶液置于烧杯中,加入250mL蒸馏水稀释,混匀即得250mL 浓度约为0.1mol·L-1的醋酸溶液,将其储存于试剂瓶中备用。
2.醋酸溶液的标定
用移液管准确移取25.00mL醋酸溶液(V1)于锥型瓶中,加入1滴酚酞指示剂,用标准NaOH溶液(c2)滴定,边滴边摇,待溶液呈浅红色,且半分钟内不褪色即为终点。由滴定管读出所消耗的NaOH溶液的体积V2,根据公式c1V1 = c2V2计算出醋酸溶液的浓度c1。平行做三份,计算出醋酸溶液浓度的平均值。
…… …… 余下全文
