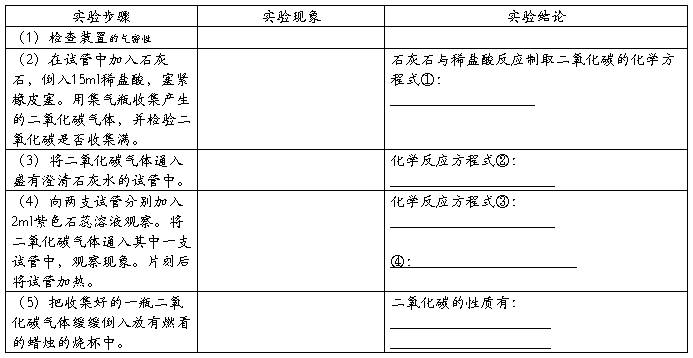
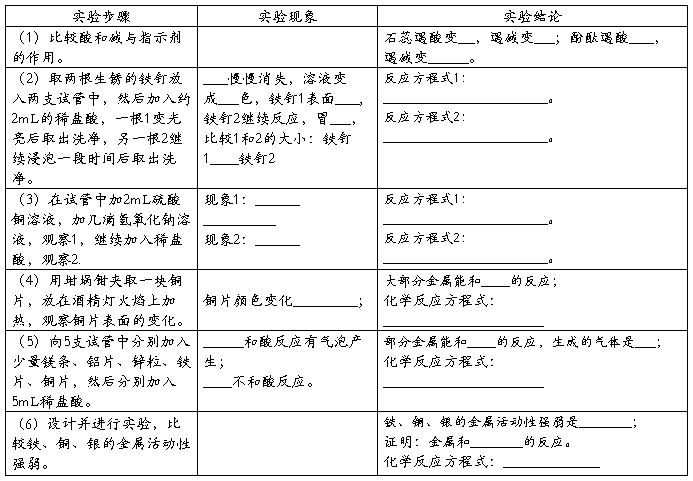
实验室氯酸钾制取氧气实验报告
一、实验目的
1、练习实验室制取氧气的方法,练习用排水取气法收集气体;
2、初步了解通过化学实验制取新物质的方法;
3、认识分解反应和催化剂的概念。
二、实验原理

1、原理:
2、O2物理性质:在通常状况下,O2为无色无味的气体、密度比空气的略大,可以用向上排空气法收集氧气。O2不易溶于水,所以通常采用排水法收集氧气。
三、实验用品
大试管、单孔橡皮塞、胶皮管、玻璃导管、集气瓶、水槽、铁架台(带铁夹)、酒精灯、玻璃片、坩埚钳(镊子) 、研钵、试管夹。
氯酸钾、二氧化锰、火柴。
四、实验步骤


步骤:
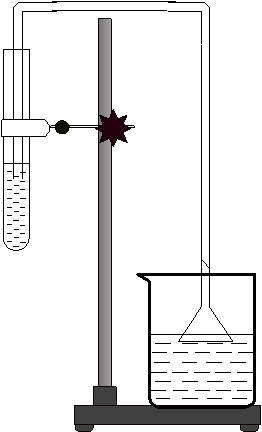
1、如上图所示连接仪器组装装置。用带有导管的橡皮塞塞紧试管,并检查装置是否漏气,不漏气的装置才能进行实验。
2、查:检查装置的气密性,将导管口伸入水面以下,用手紧握试管,观察导管口是否有气泡产生,若有气泡产生,则证明装置气密性好。
,在试管里放进约9g氯酸钾和3g二氧化锰。然后
3、装:拔下橡皮塞,用药匙取三药匙氯酸钾于研钵中轻轻研碎,再加入一药匙二氧化锰充分混合均匀。然后用纸槽送入试管底部,把带有导管的橡皮塞塞紧试管口。并将集气瓶装满水(不能留有气泡),用玻璃片盖好倒置于水槽中。
4、定:将装有氯酸钾和二氧化锰混合物的试管固定在铁架台,用铁夹夹持在距试管口的三分之一处,试管口略微向下倾斜。
5、点:取下酒精灯灯帽正放于桌面,点燃酒精灯先给试管进行预热(用手端着酒精灯在试管下方左右来回移动,让试管均匀受热),然后集中加热装有药品的部位。
6、收:导管口开始有气泡放出时,不宜立即收集,有连续并均匀的气泡冒出时,再把导管口伸入盛满水的集气瓶口开始收集氧气,当集气瓶口有气泡冒出时,证明已收集满,在水面下用玻璃片盖好瓶口取出集气瓶迅速倒置于桌面。
…… …… 余下全文