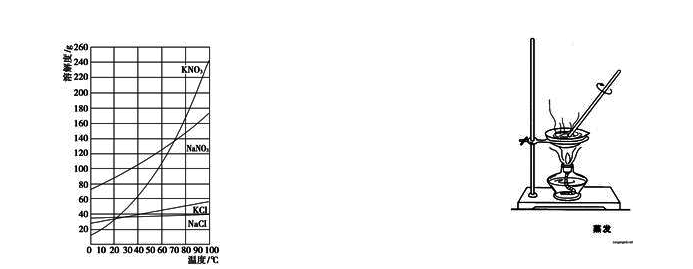实验十 转化法制备硝酸钾
[课时安排] 4学时
[实验目的]
1、学习用转化法制备硝酸钾晶体;
2、学习溶解、过滤、间接热浴和重结晶操作。
[实验原理介绍]
本实验是采用转化法由NaNO3和KCl来制备硝酸钾,其反应如下:
NaNO3+ KCl?NaCl + KNO3
该反应是可逆的。根据氯化钠的溶解度随温度变化不大,而氯化钾、硝酸钠和硝酸钾在高温时具有较大或很大的溶解度而温度降低时溶解度明显减小(如氯化钾、硝酸钠) 或急剧下降(如硝酸钾)的这种差别,将一定浓度的硝酸钠和氯化钾混合加热浓缩,当温度达118~120℃时,由于硝酸钾溶解度增加很多,达不到饱和,不析出;而氯化钠的溶解度增加很少,随浓缩、溶剂的减少,氯化钠析出。通过热过滤滤除氯化钠,将此溶液冷却至室温,即有大量硝酸钾析出,氯化钠仅有少量析出,从而得到硝酸钾粗产品。再经过重结晶提纯,可得到纯品。
[基本操作与仪器介绍]
1、布氏漏斗及吸滤瓶的使用方法
布氏漏斗和吸滤瓶配套使用于减压过滤。布氏漏斗上有许多小孔,漏斗颈插入单孔橡皮塞,与吸滤瓶相接。橡皮塞插入吸滤瓶内的部分不得超过塞子高度的2/3,漏斗管下方的斜口要对着吸滤瓶的支管口。
2、减压过滤的操作方法
(1) 按1装好仪器,滤纸放入布氏漏斗内(滤纸大小应小于漏斗内径并能将全部小孔盖住为宜)。少量蒸馏水润湿滤纸,开启真空泵,抽气使滤纸紧贴在漏斗上。
(2) 用倾析法先将上清液转移到漏斗上,溶液量不应超过漏斗容量的2/3,待溶液快流尽时再转移沉淀。
(3) 如果吸滤瓶内液面高度快到支管时,拔掉吸滤瓶上的橡皮管,从吸滤瓶上口倒出溶液,不能从支管口倒出溶液,以免弄脏溶液。
(4) 先拔掉橡皮管,用洗涤液润湿沉淀,然后重新接上橡皮管,尽量抽干,重复此操作2~3次。
…… …… 余下全文