华南 师 范 大学 实验 报 告
学生姓名 学 号
专 业 化学(师范) 年级、班级
课程名称 物理化学实验 实验项目纯液体饱和蒸气压的测定——静态法
实验类型 :□验证□设计□综合 实验时间 年 月 日
…… …… 余下全文
华南 师 范 大学 实验 报 告
学生姓名 学 号
专 业 化学(师范) 年级、班级
课程名称 物理化学实验 实验项目纯液体饱和蒸气压的测定——静态法
实验类型 :□验证□设计□综合 实验时间 年 月 日
…… …… 余下全文


一、目的要求
1. 明确纯液体饱和蒸气压的定义和汽液两相平衡的概念,深入了解纯液体饱和蒸气压与温度的关系公式——克劳修斯-克拉贝龙方程式。
2. 用数字式真空计测量不同温度下环己烷的饱和蒸气压。初步掌握真空实验技术。
3. 学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸点。
二、实验原理
通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发1mol液体所吸收的热量称为该温度下液体的摩尔气化热。
液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为1atm(101.325kPa)时,液体的沸点称为该液体的正常沸点。
液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示为:

式中,R为摩尔气体常数;T为热力学温度;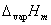 为在温度T时纯液体的摩尔气化热。 假定
为在温度T时纯液体的摩尔气化热。 假定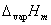 与温度无关,或因温度范围较小,
与温度无关,或因温度范围较小,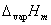 可以近似作为常数,积分上式,得:
可以近似作为常数,积分上式,得:
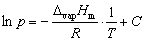
其中C为积分常数。由此式可以看出,以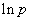 对1/T作图,应为一直线,直线的斜率为
对1/T作图,应为一直线,直线的斜率为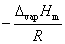 ,由斜率可求算液体的
,由斜率可求算液体的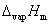 。
。
三、仪器、试剂
蒸气压测定装置 1套 循环式真空泵 1台
精密数字压力计 1台 数字控温仪 1只
…… …… 余下全文
液体饱和蒸汽压的测定
一、实验目的
1.明确液体饱和蒸汽压的意义,熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯-克拉贝农方程。
2.了解静态法测定液体饱和蒸汽压的原理。
3.学习用图解法求解被测液体在试验温度范围内的平均摩尔蒸发焓与正常沸点。
二、实验原理
1.热力学原理
通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发1mol液体所吸收的热量称为该温度下液体的摩尔气化热。
液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变。当外压为101.325kPa时,液体的沸点称为该液体的正常沸点。
液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示:
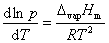 (1)
(1)
式中,R为摩尔气体常数;T为热力学温度;ΔvapHm为在温度T时纯液体的摩尔气化热。
假定ΔvapHm与温度无关,或因温度范围较小,ΔvapHm可以近似作为常数,积分上式,得:
 (2)
(2)
…… …… 余下全文



实验题目:液体饱和蒸汽压的测定
学 院: 化学与化工学院
专 业: 生物工程
年 级: 112班
学 号: 1108110358
学生姓名: 孙宇
指导教师: 吴玉娟
20## 年 3月 30 日
(一) 实验目的
1. 明确液体饱和蒸气压的定义,了解纯液体的饱和蒸气压与温度的关系以及克劳修斯-克拉佩龙方程的意义。、
2. 掌握用静态法测定液体饱和蒸气压的方法,学会用图解法求被测液体在试验温度的范围内的平津摩尔气化焓。
3. 初步掌握真实试验技术,了解恒温槽及等压计的使用方法。
…… …… 余下全文
液体饱和蒸汽压的测定
一、实验目的
1.明确液体饱和蒸汽压的意义,熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯-克拉贝农方程。
2.了解静态法测定液体饱和蒸汽压的原理。
3.学习用图解法求解被测液体在试验温度范围内的平均摩尔蒸发焓与正常沸点。
二、实验原理
1.热力学原理
通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发1mol液体所吸收的热量称为该温度下液体的摩尔气化热。
液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变。当外压为101.325kPa时,液体的沸点称为该液体的正常沸点。
液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示:
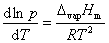 (1)
(1)
式中,R为摩尔气体常数;T为热力学温度;ΔvapHm为在温度T时纯液体的摩尔气化热。
假定ΔvapHm与温度无关,或因温度范围较小,ΔvapHm可以近似作为常数,积分上式,得:
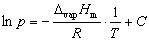 (2)
(2)
…… …… 余下全文
华南师范大学实验报告
学生姓名 学 号
专 业 化学(师范)__ 年级、班级 ___
课程名称 物理化学实验 实验项目 饱和蒸汽压的测定
实验类型 □验证 □设计 □综合 实验时间 _ 20XX 年 11 月 19 日
实验指导老师 _李国良老师 _ 实验评分
【实验目的】
1.明确纯液体饱和蒸汽压和蒸汽压的概念及其与温度的关系,加深对劳修斯-克拉贝龙方程式的理解。
2.掌握静态法测定纯液体饱和蒸汽压的原理及方法,并学会用图解法求纯液体的平均并学会由图解法求其平均摩尔气化热和正常沸点。
3.了解数字式低真空侧压仪=,熟悉常用的气压计的使用及校正的方法,初步掌握真空实验技术。
【实验原理】
在封闭体系中,当液相的蒸发速度与相应气相的凝聚速度相等时,体系达到动态平衡,此时的蒸气压为该温度下的饱和蒸气压,液体的饱和蒸气压等于外压时的温度为液体的沸点,因此沸点是随外压变化的,当外压为101.325KPa时,称之为正常沸点。每蒸发1mol液体所需的热量称该温度下的摩尔汽化热。
克拉贝龙-克劳修斯方程描述了饱和蒸气压,温度与摩尔汽化热之间的关系:
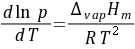 式中,T为热力学温度,K;p为纯液体在温度T时的饱和蒸汽压,Pa;R为摩尔气体常数,8.314J/(mol·K);△vapHm为纯液体在在温度为T时的摩尔汽化热,J/mol。
式中,T为热力学温度,K;p为纯液体在温度T时的饱和蒸汽压,Pa;R为摩尔气体常数,8.314J/(mol·K);△vapHm为纯液体在在温度为T时的摩尔汽化热,J/mol。
它是克拉贝龙方程式的简化形式,可以根据该式测定液体的饱和蒸气压。饱和蒸汽压是液体工质最基本的物性参数之一, 是化工、生产、科研、设计过程中的重要基础数据,所以掌握通常测量饱和蒸气压的方法具有很大的实际意义。
液体饱和蒸汽压的测量方法主要有三种:静态法,动态法和饱和气流法。动态法是指在不同外界压力下, 测定液体的沸点, 又称沸点法。动态法与其它两种方法相比具有操作简单,结果比较准确的优点,适用于蒸气压不太高的液体。本实验采用动态法来测量水的饱和蒸气压,并由此得到水的正常沸点和摩尔汽化热。
…… …… 余下全文
实验名称:液体饱和蒸汽压的测定
报告人:曾辉 实验时间20##年05月04日一、实验目的:
(1)明确液体饱和蒸汽压的定义,熟悉纯液体的饱和蒸汽压与温度的关系,即克劳休斯-克拉贝农方程。
(2)了解静态法测定液体饱和蒸汽压的原理。
(3)学习用图解法求解被测液体在试验温度范围内的平均摩尔蒸发焓与正常沸点。
二、实验原理:
1、热力学原理
在远低于液体临界温度下,处于密闭的真空容器中的液体,一些动能较大的液体分子可从液相进入气相,而动能较小的蒸汽分子因碰撞而凝结成液相,当这两个过程的速度相等时,气液两相建立动态平衡,此时液面上的蒸汽压力就是该温度下该液体的饱和蒸汽压,简称为蒸汽压。蒸发1mol液体所吸收的热量称为该温度下液体的摩尔蒸发焓,用ΔvapH*m表示。
纯液体的蒸气压随温度的变化而变化,当温度升高,分子运动加剧,更多的高动能分子由液相进入气相,因而蒸气压增大;反之,温度降低,则蒸气压减小。当蒸气压等于外界压力时,液体更沸腾,此时的温度称为沸点,所以,外压不同时,液体的沸点也不同,当外压为101.325kPa时,液体的沸点称为该液体的正常沸点。
液体的饱和蒸气压与温度的关系用克劳休斯-克拉贝农方程式表示为
Dlnp/dT=ΔvapH*m/RT2 (1)
…… …… 余下全文
