
第一部分:实验预习报告
1. 实验目的(要求)
测定弱电解质电离平衡常数
了解指示剂变色反应原理
学习使用721型(或VIS-7220型)分光光度计及pHS-3C酸度计
2. 实验原理(概要)
甲基红是一种酸碱指示剂。它是一种弱酸,在一定pH值条件下,可发生电离,在乙醇水溶液中点力度很小。甲基红(HMR)醌式分子显红色,电离后的偶氮式阴离子( MR¯ )显黄色。
甲基红的电离平衡常数 为:
为:
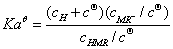
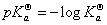
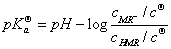
根据朗伯-比尔定律,溶液对单色光的吸收遵守下列关系式: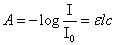
A为吸光度, 为透光率,
为透光率, 为摩尔吸光系数,l为被测溶液厚度,c为浓度。令
为摩尔吸光系数,l为被测溶液厚度,c为浓度。令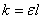
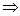
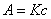 即被测溶液的吸光度与其浓度成正比。
即被测溶液的吸光度与其浓度成正比。
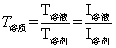
a. 若两种溶质的特征波长相差较大,被测溶质的吸收光谱图不重叠
b. 若两种被测溶质的吸收光谱图重叠,而且遵守朗伯-比尔定律,则用线性组合的关系式可求出两种被测组分的浓度。

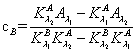
3. 实验操作过程概述:
1溶液制备。
甲基红标准液:80mg甲基红晶体分次以600mL乙醇溶解移入1000mL容量瓶中
A液:10mL甲基红标准液+10HCl加水定容于100mL容量瓶。(HMR醌式分子溶液,红色)
B液:10mL甲基红标准液+25mLNaAc溶液加水定容于100mL容量瓶。(甲基红偶氮式阴离子溶液,黄色)
2吸收光谱图的标绘
(1)调节VIS-7220型分光光度计
(2)测定溶液A和溶液B的吸收光谱图
3验证朗伯-比尔定律
测定 ,
,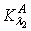 ,
, ,
, :取6个干燥的锥形瓶(50mL),分别编号。摇匀各瓶溶液。在波长
:取6个干燥的锥形瓶(50mL),分别编号。摇匀各瓶溶液。在波长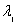 ,
, 下测定6个锥形瓶中各溶液的吸光度A。若在处HMR及
下测定6个锥形瓶中各溶液的吸光度A。若在处HMR及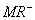 的溶液均符合朗伯-比尔定律,则以溶液A,B及上述6种溶液的吸光度与甲基红的浓度,可以作HMR和
的溶液均符合朗伯-比尔定律,则以溶液A,B及上述6种溶液的吸光度与甲基红的浓度,可以作HMR和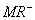 分别在波长
分别在波长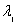 ,
, 下的4条A-c直线。它们的斜率分别为
下的4条A-c直线。它们的斜率分别为 ,
,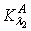 ,
, ,
, :。
:。
…… …… 余下全文

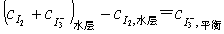
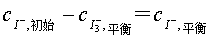
 A(溶剂1) B(溶剂2)
A(溶剂1) B(溶剂2)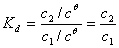
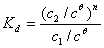
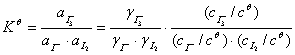
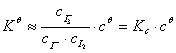

 与反应物起始浓度无关。
与反应物起始浓度无关。 

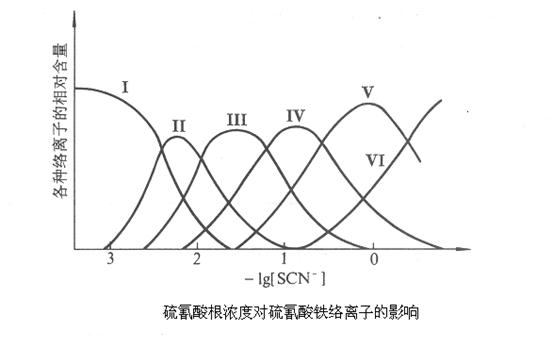

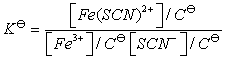
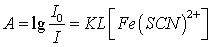
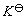 。
。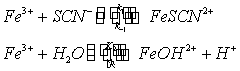


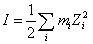 必须保持一致。
必须保持一致。 I-+I2平衡常数的测定
I-+I2平衡常数的测定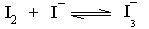 在恒温下,碘(I2)溶在含有碘离子(I-)的溶液中,大部分成为络离子(I3-),并存在下列平衡:
在恒温下,碘(I2)溶在含有碘离子(I-)的溶液中,大部分成为络离子(I3-),并存在下列平衡: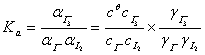 (2)
(2)