华 南 师 范 大 学 实 验 报 告
学生姓名 学 号
专 业 年级、班级
课程名称 实验项目 液相反应平衡常数的测定
…… …… 余下全文
I3- → I-+I2平衡常数的测定
I-+I2平衡常数的测定
一、 实验目的
1. 测定I3- →I-+I2 的平衡常数。
2. 加强对化学平衡、平衡常数的理解并巩固平衡移动的原理。
3. 练习滴定操作。
二、 实验原理
碘溶于碘化钾溶液中并建立下列平衡
I3- →I-+I2 (1)
在一定温度条件下其平衡常数为:K= c(I-)* c(I2)/ c(I3-) (2)
…… …… 余下全文
华 南 师 范 大 学 实 验 报 告
学生姓名 学 号
专 业 化学(师范) 年级、班级
课程名称 物理化学实验 实验项目 液相反应平衡常数的测定
实验类型 :□验证□设计□综合 实验时间 年 月 日
…… …… 余下全文
醋化反应平衡常数的测定
(一)目的要求
1.由化学分析方法测定醋化反应的平衡常数
2.加深理解化学平衡和化学平衡常数的意义
(二)原理
乙酸和乙醇反应生成乙酸乙酯和水;乙酸乙酯水解得到乙酸和乙醇:CH3COOH+C2H5OH→CH3COOC2H5+H2O
在一定条件下,当正向反应和逆向反应速度相等时,反应物和产物的浓度就不再随时间的变化而变化,这种状态称为化学平衡。化学平衡是个动态平衡。
反应达到平衡时,产物浓度的乘积与反应物浓度的乘积的商值叫做平衡常数。热力学平衡常数K。用活度a表示。
αCH3COOC2H5αH2O ΧCH3COOC2H5γCH3COOC2H5ΧH2OγH2O
K=-------------=---------------------------- (1)
αCH3COOHαC2H5OH ΧCH3COOHγCH3COOC2H5ΧC2H5OHγC2H5OH
在指定温度下,热力学平衡常数的数值不因反应物的起始浓度不同而发生变化,所以热力学平衡常数的数值可以作为反应进行程度的标志,Kα越大,反应进行程度越高。
显然K与Kα的关系为:
γCH3COOHγC2H5OH
K=Kα·------------- (2)
…… …… 余下全文
实验六 电导法测定乙酸电离平衡常数
报告人:曾辉 实验时间20##年03月07日
一.实验目的:
1.掌握电导、电导率、摩尔电导率的概念以及它们之间的相互关系。
3.掌握电导法测定弱电解质电离平衡常数的原理。
二.实验原理:
1.电离平衡常数Kc的测定原理
在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务。在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为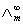 ,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率
,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率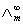 是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
 (1)
(1)
式中为弱电解质的电离度。
对AB型弱电解质,如乙酸(即醋酸),在溶液中电离达到平衡时,其电离平衡常数Kc与浓度c和电离度α的关系推导如下:
CH3COOH →CH3COO- + H+
起始浓度 c 0 0
…… …… 余下全文
恒压过滤常数测定实验
1 实验目的
1.1 熟悉板框压滤机的构造和操作方法。
1.2 通过恒压过滤实验,验证过滤基本理论。
1.3 学会测定过滤常数K、qe、τe及压缩性指数s的方法。
1.4 了解过滤压力对过滤速率的影响。
2 基本原理
过滤是以某种多孔物质为介质来处理悬浮液以达到固、液分离的一种操作过程,即在外力的作用下,悬浮液中的液体通过固体颗粒层(即滤渣层)及多孔介质的孔道而固体颗粒被截留下来形成滤渣层,从而实现固、液分离。因此,过滤操作本质上是流体通过固体颗粒层的流动,而这个固体颗粒层(滤渣层)的厚度随着过滤的进行而不断增加,故在恒压过滤操作中,过滤速度不断降低。
过滤速度 u 定义为单位时间单位过滤面积内通过过滤介质的滤液量。影响过滤速度的主要因素除过滤推动力(压强差)p,滤饼厚度 L 外,还有滤饼和悬浮液的性质,悬浮液温度,过滤介质的阻力等。
过滤时滤液流过滤渣和过滤介质的流动过程基本上处在层流流动范围内,因此,可利用流体通过固定床压降的简化模型,寻求滤液量与时间的关系,可得过滤速度计算式:
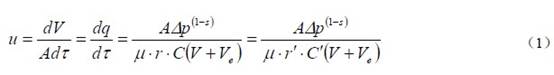
式中:u —过滤速度,m/s;
V —通过过滤介质的滤液量,m3;
A —过滤面积,m2;
τ —过滤时间,s;
q —通过单位面积过滤介质的滤液量,m3/m2;
p —过滤压力(表压)pa ;
s —滤渣压缩性系数;
μ—滤液的粘度,Pa.s;
r —滤渣比阻,1/m2;
C —单位滤液体积的滤渣体积,m3/m3;
Ve —过滤介质的当量滤液体积,m3;
r‘ —滤渣比阻,m/kg;
C—单位滤液体积的滤渣质量,kg/m3。
对于一定的悬浮液,在恒温和恒压下过滤时,μ、r、C 和△p都恒定,为此令:

…… …… 余下全文
恒
一、实验目的
1、掌握恒压过滤常数K、通过单位过滤面积当量滤液量qe、当量过滤时间?e的测定方法;加深K、qe、?e的概念和影响因素的理解。
2、 学习滤饼的压缩性指数s和物料常数k的测定方法。
3、 学习d?——q一类关系的实验测定方法。 dq
4、 学习用正交试验法来安排实验,达到最大限度的减小实验工作量的目的。
5、 学习对正交试验法的实验结果进行科学的分析,分析出每个因素重要性的大小,指出试
验指标随各因素的变化趋势,了解适宜操作条件的确定方法。
二、实验内容
1、设定试验指标、因素和水平。因可是限制,分4个小组合作共同完成一个正交表。故同意规定实验指标为恒压过滤常数K,设定的因素及其水平如表6-1所示。假定各因素之间无交互作用。
2、为便于处理实验结果,应统一选择一个合适的正交表。
3、按选定正交表的表头设计,填入与各因素水平对应的数据,使它变成直观的“实验方案”表格。
4、分小组进行实验,测定每个实验条件下的过滤常数K、q
5、对试验指标K进行极差分析和方差分析;之处各个因素重要性的大小;讨论K随其影响因素的变化趋势;以提高过滤速度为目标,确定适宜的操作条件。
三、实验原理
1.恒压过滤常数K、qe、?e的测定方法。
在过滤过程中,由于固体颗粒不断地被截留在介质表面上,滤饼厚度增加,液体流过固体颗粒之间的孔道加长,而使流体阻力增加,故恒压过滤时,过滤速率逐渐下降。随着过滤的进行,若得到相同的滤液量,则过滤时间增加。
恒压过滤方程
(q?qe)2?K(???e)
式中q———单位过滤面积获得的滤液体积,m/m; 32 (1)
qe———单位过滤面积上的当量滤液体积,m/m;
?e—当量过滤时间,s; 32
?—实际过滤时间,s;
K—过滤常数,m/s。
将式(1)进行微分可得: d?22?q?qe (2) dqKK
…… …… 余下全文
物理化学实验报告
姓名:何思思
班级:工艺五班
学号:10031010526
教师:李慎新
学院:材料化学与工程学院
电导法测定乙酸电离平衡常数
一、 实验目的
1、 掌握电导、电导率、摩尔电导率的概念以及他们之间的联系。
2、 掌握由电导法测定弱电解质电离平衡常熟的原理。
二、 实验原理
1、 电离平衡常数Kc的测定原理:
α=∧m/∧m∞
CH3COOH —→ CH3COO- + H
开始 C 0 0
平衡 C(1-α) Cα Cα
Kc= Cα²/(1-α)=C∧m²/∧m∞(∧m∞-∧m)
则:C·∧m=(∧m∞·Kc/∧m)- (∧m∞·Kc)
2、 摩尔电导率 的测定原理:
∧m=κ/C G=κA/l κ=l/A·G=Kcell·G
G:电阻的倒数 κ:电阻率的倒数
3、不同温度下醋酸的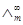 (S·m2·mol-1)
(S·m2·mol-1)
…… …… 余下全文
