实验八 酸碱反应与缓冲溶液
实验目的
1.进一步理解和巩固酸碱反应的有关概念和原理(同离子效应 盐类水解及其影响因素)
2.学习试管实验的一些基本操作
3.学习缓冲溶液的配制及其PH的的测定,了解缓冲溶液的缓冲性能
4.学习酸度计的使用方法
实验原理
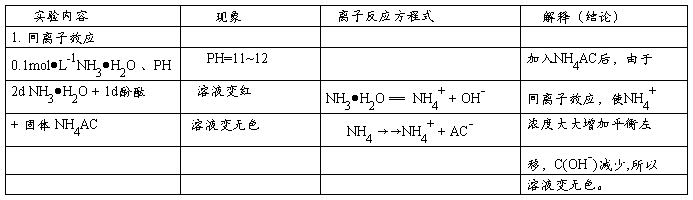
1.同离子效应
强电解质兹水中全部解离。弱电解质在水中部分解离。在一定温度下,弱酸弱碱的竭力平衡如下;
HA(ag)+H2O(l)?H3O+(ag)+A-(ag)
B(ag)+H2O(l)?BH+(ag)+OH-(ag)
在弱电解质溶液中,加入弱电解质含有相同离子的强电解质解离平衡向生成弱电解质的方向移动,是弱电解质的接力度下降。这种现象成为:同离子效应。
2.盐类水解
强酸、强碱盐在水中不水解。强酸弱碱盐(如NH4Cl)水解溶液显酸性,强酸弱碱盐(如NaAc)水解溶液显碱性。弱酸弱碱盐(如NaAc)水解溶液的酸碱性取决于强酸弱碱的相对强弱。例如:
Ac-(ag)+H2O(l)?HAc(ag)+OH-(ag)
NH4+(ag)+Ac-(ag)+H2O(l)?NH3·H2O(ag)+HAc(ag)
水解反应时酸碱中和反应的逆反应。中和反应是放热反应水解反应时吸热反应。因此升高温度有利于盐类的水解
3.缓冲溶液
由弱酸(或弱碱)与弱酸(或弱碱)盐(如HAc-NaAc;NH3·H2O-NH4Cl;H3PO4-NaH2PO4;NaHPO4;NaHPO4-Na3PO4等)组成的溶液具有保持溶液PH相对稳定的性质,这类溶液称为缓冲溶液。
由弱酸弱碱盐组成的缓冲溶液的PH可由下列公式计算:
PH=PKg?(HA)-lgc(HA)/c(A-)
由弱酸-弱碱盐组成的缓冲溶液的PH可用下式计算;
PH=14-PKb?(B)+lgc(B)/c(BH)
缓冲溶液的PH可以用PH试纸来测定
…… …… 余下全文