酸碱标准溶液浓度的标定





…… …… 余下全文
实验一酸碱标准溶液的配制和标定
实验目的
1. 掌握标准溶液的配制方法。
2. 掌握滴定法定量测定溶液浓度的原理,熟悉滴定管、移液管的准备、使用及滴定操作。
3. 熟悉甲基橙和酚酞指示剂的使用和终点的确定。
实验原理
酸碱滴定法是化学定量分析中最基本的分析方法。一般能与酸或碱直接(或间接)发生酸碱反应的物质大多可用酸碱滴定法测定他们的浓度。
按酸碱反应方程式中的化学计量系数之比,酸与碱完全中和时的pH值称为化学计量点,达到化学计量点时,应满足如下基本关系:
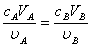
式中,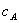 、
、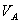 、
、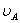 分别为酸的“物质的量”浓度、体积、化学计量系数;
分别为酸的“物质的量”浓度、体积、化学计量系数;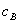 、
、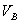 、
、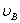 分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的化学计量系数由酸碱反应方程式决定。
分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的化学计量系数由酸碱反应方程式决定。
由于酸、碱的强弱程度不同,因此酸碱滴定的化学计量点不一定在pH=7处。通常,酸碱溶液为无色,酸碱中和是否完全,需用指示剂的变色来判断。指示剂往往是一些有机的弱酸或弱碱,它们在不同pH值条件下颜色不同。用作指示剂时,其变色点(在化学计量点附近)的pH值称为滴定终点。选用指示剂要注意:①变色点与化学计量点尽量一致;②颜色变化明显;③指示剂用量适当。
酸碱滴定中常用HCl和NaOH溶液作为标准溶液,但由于浓HCl容易挥发,NaOH固体容易吸收空气中的H2O和CO2,直接配成的溶液其浓度不能达到标准溶液的精度,只能用标定法加以标定。基准物质H2C2O4的分子式确定,化学性质稳定,不易脱水或吸水,可以准确称量,所以,本实验采用(H2C2O4·2H2O,摩尔质量为126.07g·mol-1) 为基准物质,配成H2C2O4标准溶液。以酚酞为指示剂,用H2C2O4标准溶液标定NaOH溶液;再以甲基橙为指示剂,用标定后的NaOH标准溶液滴定HCl溶液,从而得到HCl标准溶液。
…… …… 余下全文
酸碱标准溶液浓度的标定
院系:化学化工系 年级专业:10级化学(师范) 姓名:孙璇璇 手机号
码:182xxxxxxxx一、 实验目的
1、通过中和滴定实验,掌握中和滴定实验操作方法.
2、通过酸碱中和实验,理解化学实验中测定酸或碱的浓度的基本方法.
3、通过中和滴定实验,进一步了解酸碱滴定的基本原理。
4、初步掌握酸碱指示剂的选择方法,熟悉指示剂的使用和终点的判据。
二、实验原理
酸碱标准溶液是采用间接法配制的,其准确浓度必须依靠基准物质来标定,只要标定出其中任何一种溶液浓度,然后按它们的体积比VHCl
另一种标准溶液的浓度。
标定酸碱溶液的基准试剂比较多,现各举二种常用的例子。
1、 标定碱的基准物质
(1)邻苯二甲酸氢钾(KHC8H4O4),它易制得纯品,在空气中不吸水,容易
保存,摩尔质量较大,是一种较好的基准物质,标定反应如下:
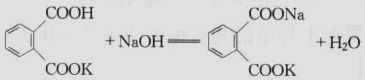
VNaOH来计算出
反应产物为二元弱酸,在水溶液中显微碱性,可选用酚酞作指示剂。
邻苯二甲酸氢钾通常在105~110?C下干燥2h后备用,干燥温度过高,则脱水成为邻苯二甲酸酐。
(2)草酸(H2C2O4?2H2O),它在相对湿度为5%~95%时不会风化失水,故将
其保存在磨口玻璃瓶中即可,草酸固体状态比较稳定,但溶液状态的稳定性较差, 1
空气能使H2C2O4慢慢氧化,光和Mn2+能催化其氧化,因此,H2C2O4溶液应置于暗处存放。
草酸是二元酸,由于Ka1与Ka2值相近,不能分步滴定,但两级解离的H+一次被滴定。标定反应为:
2NaOH+H2C2O4=Na2C2O4+2H2O
反应产物为Na2C2O4,在水溶液中呈微碱性,也可采用酚酞为指示剂。 2、标定酸的基准物质
(1)无水碳酸钙(Na2CO3),它易吸收空气中的水分,先将其置于270~300
?C干燥1h,然后保存于干燥器中备用,其标定反应
…… …… 余下全文
实验三 酸碱标准溶液配制、浓度的比较和标定
1.实验目的
1.1熟练分析天平的使用方法。
1.2掌握酸碱标准溶液的配制、浓度的比较和标定的表达。
2.实验仪器
2.1量筒(10ml、100ml)、试剂瓶(500ml)、洗瓶、移液管(25ml)、酸式滴定管(50ml)、碱式滴定管(50ml)、滴定台、锥形瓶(250ml)
2.2浓盐酸、NaOH(10mol/L)、Na2CO3、Na2B4O7 10H2O、邻苯二甲酸氢钾、酚酞指示剂(2g/L的乙醇)、甲基橙指示剂(2g/L)、甲基红指示剂(2g/L)
3.实验原理
用已知浓度的Na2CO3与HCL反应,在指示剂的作用下观察滴定终点,根据反应式算得HCL得浓度,再用相同的方法用HCL来测定未知NaOH的浓度。
4.实验步骤
4.1实验前准备:
4.11检查移液管管尖是否破损,是否漏水,容量瓶是否严密。
4.12分别用自来水、蒸馏水洗涤仪器
4.2 HCL与 NaOH溶液的配制:
4.21用量筒取4~4.5ml浓盐酸,倒入500ml试剂瓶中,加水稀释至500ml,盖上玻璃塞并摇匀。
4.22用量筒取10mol/L NaOH溶液5ml,倒入500ml试剂瓶中,加水稀释至500ml,盖上橡皮塞并摇匀。
4.3用酸和碱溶液分别润洗滴定管,在滴定管中加入酸溶液,将液面调到0刻度线或以下,读出初始读数。
4.4用分析天平称量0.11~0.14g Na2CO3固体3份,置于3个250ml的锥形瓶中,加20~30ml水后加入2滴甲基橙指示剂,分别用盐酸滴定至溶液由黄色变橙色,读出读数
4.5用盐酸滴定NaOH溶液,至溶液由黄色变橙色,实验3次结束
…… …… 余下全文
酸碱标准溶液的配制和标定
2012-12-13
化学化工系 11化工与制药2班 蒋晓濛 手机号:150xxxxxxxx
一.实验目的
1、掌握NaOH、HCl标准溶液的配制、保存方法
2、通过练习滴定操作,初步掌握半滴操作和用甲基橙、酚酞指示剂确定终点的方法
二.实验原理
浓盐酸因含有杂质而且易挥发,氢氧化钠因易吸收空气中的水分和CO2,不能直接配制成准确浓度的溶液,只能先配成近似浓度的溶液,然后用其他基准物质进行标定。 常用于标定酸溶液的基准物质有:碳酸钠Na2CO3
常用于标定碱溶液的基准物质有:邻苯二甲酸氢钾KHC8H4O4
用Na2CO3标定HCl溶液反应方程式如下:Na2CO3+2HCl==CO2+2NaCl+H2O,由反应式可知,1mol HCl正好与1/2mol Na2CO3完全反应。由于生成的H2CO3是弱酸,溶液呈酸性,可选用甲基橙作指示剂,溶液由黄色变为橙色即为终点。根据c(HCl)V(HCl)= 2m(Na2CO3)/M(Na2CO3)。即可计算出HCl的准确的浓度。式中m(Na2CO3)为每次滴定时所用的质量,g;M(Na2CO3)为Na2CO3的摩尔质量,g/mol;V(HCl)为每次滴定时所消耗盐酸标准溶液的体积,ml;c(HCl)为所求盐酸溶液的准确浓度。
用KHC8H4O4标定NaOH的反应方程式如下:KHC8H4O4+ NaOH = KNaC8H4O4+H2O,由反应式可知,1mol NaOH正好与1mol KHC8H4O4完全反应,滴定终点呈碱性,可选用酚酞作指示剂,溶液由无色变为浅粉色即为终点。根据c(NaOH)V(NaOH)= m(KHC8H4O4)/M(KHC8H4O4)。即可计算出NaOH的准确的浓度。式中m(KHC8H4O4)为每次滴定时所用的质量,g;M(KHC8H4O4)为KHC8H4O4的摩尔质量, 1
…… …… 余下全文
实验一 1酸碱标准溶液的配制标定
2有机酸摩尔质量测定
一、实验目的
1. 巩固分析天平使用方法及熟悉滴定方法。
2. 掌握用基准物质标定盐酸溶液的方法。
3. 掌握酸碱指示剂的使用
二、实验原理
1.一般的酸碱含有杂质或稳定性差,不能直接配制成准确浓度的溶液。通常是先配制成近视浓度的溶液,然后再用适当的基准物质标定出准确浓度。
标定盐酸标准溶液的基准物质有无水碳酸钠(Na2CO3)和硼砂(Na2B4O7·10H2O)。本次实验选用无水碳酸钠基准物质来标定盐酸标准溶液。化学反应方程式为:
Na2CO3+2HCl?2NaCl+H2CO3
H2CO3???CO2?+H2O?
由化学反应方程式可知,当滴定结束后,滴定产物为NaCl和H2CO3,溶液呈酸性,由酸碱指示剂的理论可知,我们应选择变色范围在酸性条件的指示剂,今天我们选择的指示剂为甲基橙指示剂。
由化学反应方程式可知:
CHCl=WNa2CO3M1
2Na2CO3 ?VHCl?1000 Na2CO3=106.0
有机酸与氢氧化钠反应方程式:nNaOH+HnA?NanA+nH2O
2.有机酸摩尔质量计算公式:
MA=mA×n/(cNaOHVNaOH) 若VNaOH 为毫升,则:
MA=mA×n/(cNaOHVNaOH)×1000
若有机物质样质量为mA,被250mL容量瓶定容后分取25.00mL进行测定,有机酸摩尔质量计算公式为:
MA=mA×n×1000/(cNaOH×VNaOH×10)
= mA×n×100/(cNaOH×VNaOH)
对于草酸((COOH)2 pK1=1.22,pK2=4.19 M=90.04)、柠檬酸(H3C6H5O7 pK1=3.13 pK2=4.76 pK3=6.40 M=192.14)和酒石酸((CH(OH)COOH)2 pK1=3.04 pK2=4.37 M=150.09)与此类似,一般用酚酞作指示剂。
…… …… 余下全文
实验二 酸碱标准溶液的配制与标定
一、实验目的:
1.掌握间接法配制HCl、NaOH标准溶液的方法。
2. 熟练掌握差减称量法称取基准物的方法及滴定操作基本技能。
3.学习酸碱标准溶液的标定方法。
二、实验原理:
在酸碱滴定法中,常用到盐酸或氢氧化钠标准溶液,它们都不宜直接配制,因为浓盐酸易挥发,浓度和纯度不一,固体氢氧化钠中常因吸收空气中的二氧化碳和水蒸气,而含有碳酸钠和水分,因此,只能先将它们配制成近似浓度的溶液。然后通过标定来确定它们的准确浓度。
1.标定盐酸的基准物质:硼砂Na2B4O7·10H2O和无水碳酸钠Na2CO3。
(1)硼砂(四硼酸钠,Na2B4O7·10H2O):易制得纯品,不易吸水,性质比较稳定,而且摩
尔质量较大(381.37g/mol),称量误差小,是标定HCl溶液常用的基准物质,但硼砂易风化失水,需保存在相对湿度为60%密闭容器中。1︰2反应,其标定反应为:
Na2B4O7·10H2O + 2HCI = 2NaCI + 4H3BO3 + 5H2O
在化学计量点时,由于生成的硼酸是弱酸,溶液pH=5.1,可用甲基橙作指示剂。
(2)无水碳酸钠(Na2CO3):容易制得纯品,摩尔质量为105.99g/mol,但易吸湿,使用前应在3000C干燥1小时,保存在干燥器中,用时称量要快,以免吸水而引入误差。1︰2反应,其标定反应为:
Na2CO3 + 2HCI = 2NaCI + CO2+ H2O
计量点时,溶液pH =3.9,可用甲基红作指示剂。
本实验采用的方法是:称取硼砂后直接用盐酸滴定的方法进行操作,根据所称硼砂的质量和滴定所用盐酸溶液的体积,求出盐酸溶液的准确浓度。
2.标定氢氧化钠的基准物质:邻苯二甲酸氢钾和草酸。
(1)邻苯二甲酸氢钾(KHC8H4O4): 易制得纯品,在空气中不吸水,易保存,且摩尔质量较大(204.23g/mol),称量误差小,是标定NaOH溶液较为理想的基准物质。1︰1反应,其标定反应为:
…… …… 余下全文
