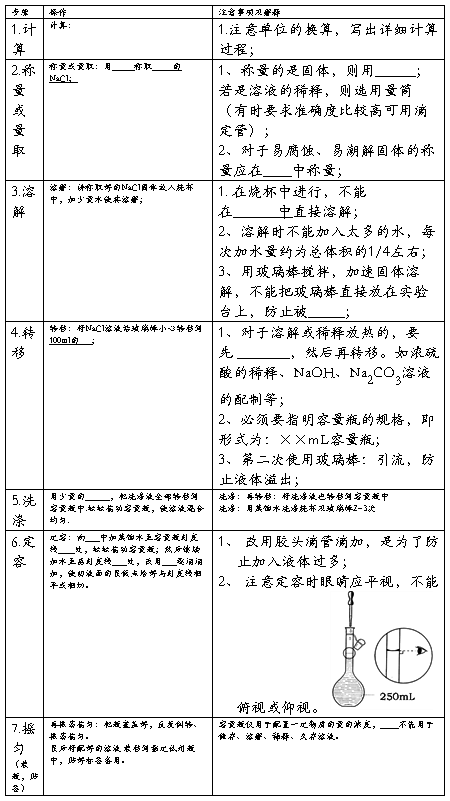
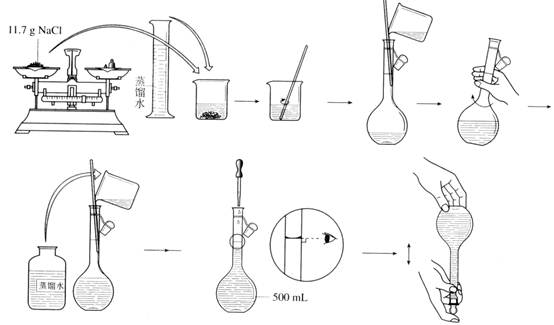
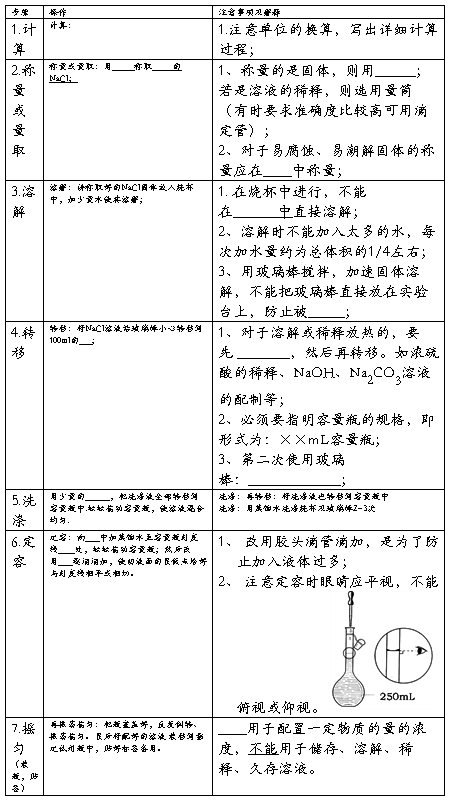
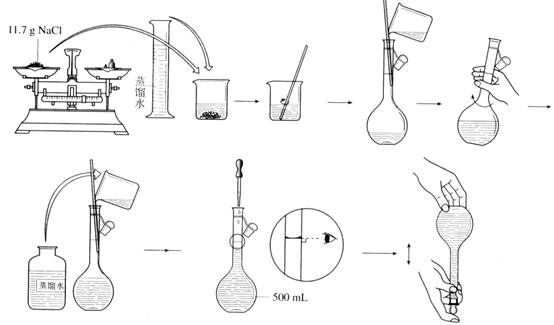
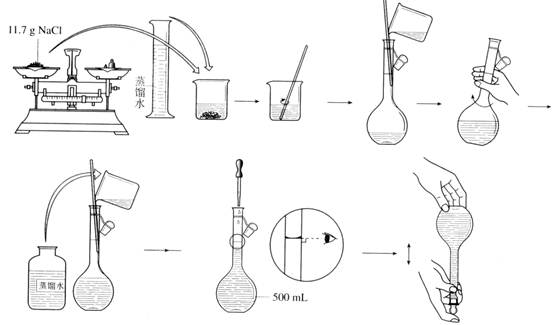
实验一 药用氯化钠的制备 (学时)
一、实验目的
1.通过沉淀反应,了解提纯氯化钠的原理;
2.练习和巩固称量、溶解、沉淀、过滤、蒸发浓缩等基本操作。
二、实验原理
粗食盐中含有不溶性杂质(如泥沙等)和可溶性杂质(主要是Ca2+、Mg2+、K- 和SO42-)。不溶性杂质,可用溶解和过滤的方法除去。可溶性杂质,可用下列方法除去,在粗食盐中加入稍微过量的BaCl2溶液时,即可将SO42- 转化为难溶解的BaSO4沉淀而除去。
Ba2+ + SO42- = BaSO4↓
将溶液过滤,除去BaSO4沉淀,再加入NaOH和Na2CO3溶液,由于发生下列反应:
Mg2+ + 2OH - = Mg(OH)2↓
Ca2+- + CO32- = CaCO3↓
Ba2+ + CO32- = BaCO3↓
食盐溶液中杂质Mg2+-、Ca2+ 以及沉淀SO42- 时加入的过量Ba2+ 便相应转化为难溶的Mg(OH)2、CaCO3、BaCO3沉淀而通过过滤的方法除去。
过量的NaOH和Na2CO3可以用盐酸中和除去。
少量可溶性杂质(如KCl)由于含量很少,在蒸发浓缩和结晶过程中仍留在溶液中,不会和NaCl同时结晶出来。
三、仪器与药品
仪器:台秤、烧杯、玻棒、量筒、布氏漏斗、吸滤瓶、循环水真空泵、蒸发皿。 药品:饱和Na2S溶液;2mol·L-1NaOH;25%BaCl2溶液;饱和Na2CO3溶液; 0.1mol·L-1和2 mol·L-1HCl;粗食盐;pH试纸;滤纸。
四、实验内容
1、在台秤上,称取30g研细的粗食盐,放入小烧杯中,加约100mL蒸馏水,用玻璃棒搅动,并加热使其溶解,至溶液沸腾时,在搅动下一滴一滴加入25%BaCl2溶液至沉淀完全(约3mL)继续加热,使BaSO4颗粒长大而易于沉淀和过滤。为了试验沉淀是否完全,可将烧杯从热源上取下,待沉淀沉降后,在上层清液中加入1~2滴BaCl2溶液,观察澄清液中是否还有混浊现象;如果无混浊现象,说明SO42-已完全沉淀,如果仍有混浊现象,则需
…… …… 余下全文