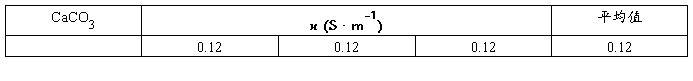宁 波 工 程 学 院
物理化学实验报告
专业班级 姓名 序号 同组姓名 指导老师 实验日期 3月31号
实验名称 实验五 电导的测定及其应用
一、实验目的
1、测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率。
2、用电导法测量醋酸在水溶液中的解离平衡常数。
3、掌握恒温水槽及电导率仪的使用方法。
二、实验原理
1、电解质溶液的导电能力通常用点到G来表示,它的单位是西门子,用符号S(西)表示,若将某电解质溶液放入两平行电板之间,两电极之间的距离为l,电极面积为A,则电导率可表示为
 (1)
(1)
式中,k为电导率,电极间距离为l,电极面积为A,l/A为电导池常数Kcell,单位为m-1。
本实验是用一种已知电导率值的溶液先求出Kcell,然后把欲测溶液放入该电导池测出其电导值G,根据(1)式求出电导率k。
…… …… 余下全文

 1、电导G:对于电解质溶液,常用电导表示其导电能力的大小。电导G是电阻R的倒数,即 G=1/R。电导的单位是西门子,常用S表示。1S=1Ω-1
1、电导G:对于电解质溶液,常用电导表示其导电能力的大小。电导G是电阻R的倒数,即 G=1/R。电导的单位是西门子,常用S表示。1S=1Ω-1 (2.5.3)
(2.5.3)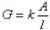 (1)
(1)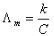 (2)
(2)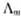 总是随着溶液的浓度降低而增大的。
总是随着溶液的浓度降低而增大的。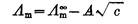 (3)
(3)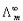 是溶液在无限稀释时的极限摩尔电导率。A为常数,故将
是溶液在无限稀释时的极限摩尔电导率。A为常数,故将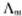 对
对 作图得到的直线外推至C=0处,可求得
作图得到的直线外推至C=0处,可求得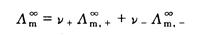 (4)
(4) 、
、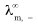 分别表示正、负离子的无限稀释摩尔电导率。
分别表示正、负离子的无限稀释摩尔电导率。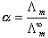 (5)
(5) (1)
(1) (2)
(2) 总是随着溶液的浓度降低而增大的。
总是随着溶液的浓度降低而增大的。 (3)
(3)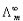 是溶液在无限稀释时的极限摩尔电导率。A为常数,故将
是溶液在无限稀释时的极限摩尔电导率。A为常数,故将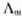 对
对 作图得到的直线外推至C=0处,可求得
作图得到的直线外推至C=0处,可求得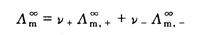 (4)
(4)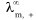 、
、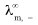 分别表示正、负离子的无限稀释摩尔电导率。
分别表示正、负离子的无限稀释摩尔电导率。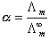 (5)
(5)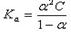 (6)
(6)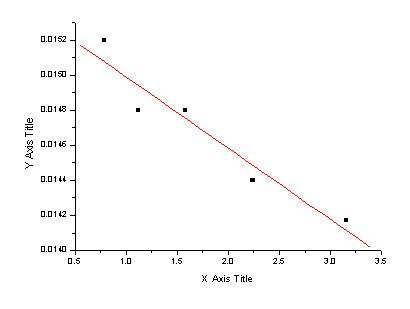
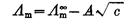 ,截距即为
,截距即为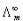 ,得
,得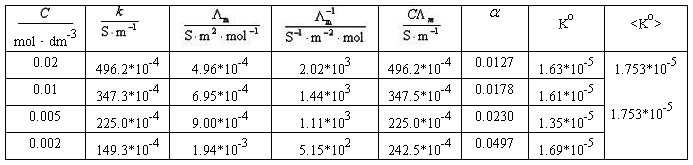
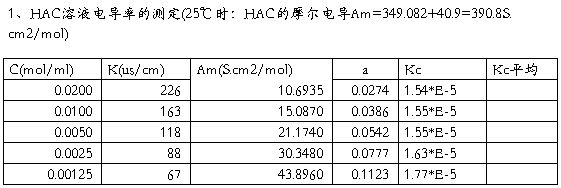
 =k=553*10-4 S·m-1
=k=553*10-4 S·m-1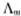 对
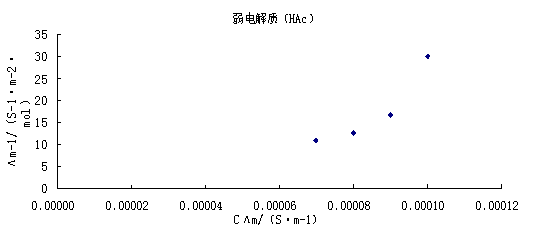
对 作图应得一直线,直线的斜率为
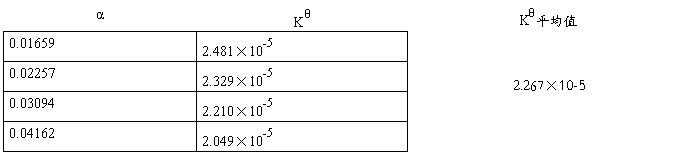
作图应得一直线,直线的斜率为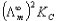 ,由此求得Ko,于上述结果进行比较。
,由此求得Ko,于上述结果进行比较。