实验报告:明矾的制备及组成测定
1. 选题背景
明矾,无色透明块状结晶或结晶性粉末,无臭,味微甜而酸涩。在干燥空气中风化失去
结晶水,在潮湿空气中溶化淌水,加热至92·5℃失去9个结晶水,200℃时失去全部结晶水成为白色粉末。易溶于水,缓慢溶于甘油,不溶于乙醇,丙酮。其水溶液呈酸性,在水中水解生成氢氧化铝胶状沉淀。明矾净水是过去民间经常采用的方法,它的原理是明矾在水中可以电离出铝离子,二氯离子容易水解,生成氢氧化铝胶体,氢氧化铝胶体吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清,因此是一种较好的净水剂。
2. 实验原理
2.1 制备明矾的原理
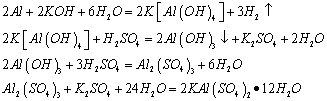 2.1.1碱法:(实验中使用)
2.1.1碱法:(实验中使用)
2.1.2 酸法:
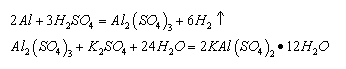
2.2 铝离子含量测定原理
Al3+与EDTA配位反应,加入过量的EDTA,并加热煮沸反应完全;AI3+对二甲酚橙指示剂
有封闭作用,酸度不够时容易水解,在pH值为3~4时Al3+与过量的EDTA在煮沸时配位完全。
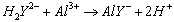
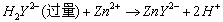
再调节pH值为5-6,以二甲酚橙指示剂,用锌盐标准溶液返滴定剩余EDTA,加入过量的 加热煮沸,置换出与
加热煮沸,置换出与 配位的EDTA,再用锌盐标准溶液滴定释放出来的EDTA,至溶液由黄色变为紫红为终点。
配位的EDTA,再用锌盐标准溶液滴定释放出来的EDTA,至溶液由黄色变为紫红为终点。


2.3 净水试验原理
明矾在水中可以电离出两种金属离子:
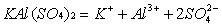
而Al3+很容易水解,生成氢氧化铝Al(OH)3胶体:

3. 实验步骤和内容
3.1 明矾的制备
…… …… 余下全文

 木棒两根 玻璃杯一个 瓷碗一个 细线一团 硬纸片一张
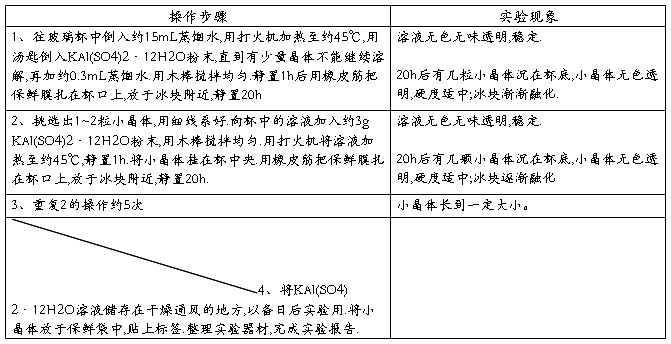
木棒两根 玻璃杯一个 瓷碗一个 细线一团 硬纸片一张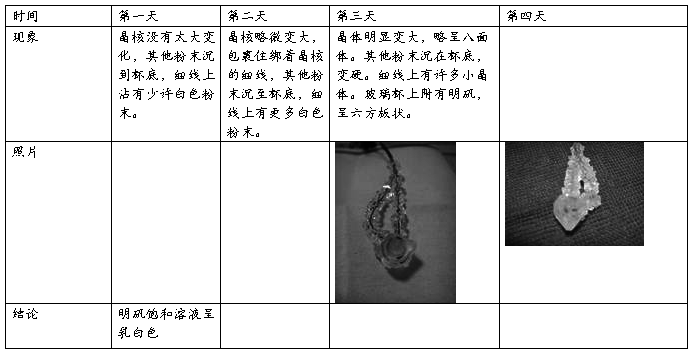

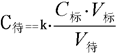

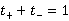
 I-+I2平衡常数的测定
I-+I2平衡常数的测定