实 验 报 告
一、 实验目的
1、掌握酸碱滴定法测定碱度的原理和方法。
2、掌握碱度测定结果的计算。
3、熟练滴定操作及相关仪器的操作方法。
二、实验原理
水的碱度主要由碳酸盐、重碳酸盐、及氢氧化物组成,但在某些情况下,如水中存在 磷酸盐、硅酸盐、硼酸盐等也会产生一定的碱度。 碱度的测定是在水样中加入适当的指示剂,用酸标准溶液进行滴定,可分别测出水样 中各种碱度,如下: OH- + H+ = H2O CO32- + H+ = HCO3- HCO3-+ H+ = H2O + CO2 根据上述到达终点时所用酸的量可计算出溶液中碳酸盐、重碳酸盐及总碱度。
三、仪器和药品 仪器:250mL锥形瓶3个;50mL酸式滴定管1支、20、50 mL移液管、50mL量筒。 试剂:0.1%酚酞指示剂、0.1%甲基橙指示剂、0.1mol/L盐酸标准溶液、0.05000mol/L Na2CO3
四、内容及步骤
(一)0.1mol/L盐酸标准溶液浓度的标定 准确量取20.00mL 已配好的0.05000mol/L Na2CO3标准溶液置于3只250mL锥形瓶中,加水约30mL,温热,摇动使之溶解,以甲基橙为指示剂,以0.lmol/LHCl标准液滴定至溶液由黄色转变为橙色,记下HCl标准溶液的消耗用量(3份测定的平均偏差应小于0.2%,否则应重复测定),并计算出HCl标准溶液的浓度。
( 二 )碱度的测定(双指示剂法) 准确移取水样l00mL于250mL锥形瓶中,加人酚酞指示剂三滴,如呈红色,用0.1mol/L盐酸溶液滴定至颜色刚好消失,记下盐酸溶液的消耗体积(P);在此溶液中,再加入2滴甲基橙指示剂,继续用标准盐酸溶液滴定至橙色为止,记下盐酸的消耗量(M)。判断水样中碱度的组成及含量。
五、实验结果记录与计算
防灾科技学院北校区实验楼自来水碱度测定结果记录
…… …… 余下全文


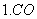 32-+H+= HCO3- HCO32-+H+=H2CO3
32-+H+= HCO3- HCO32-+H+=H2CO3 