
化学化工学院
本科学生综合性、设计性实验报告
实验课程 分析化学实验
实验项目 钡盐中钡含量的测定(沉淀重量法)
专业 班级
学号 姓名
指导教师及职称
…… …… 余下全文
一.实验目的
1.了解测定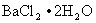 中钡的含量的原理和方法。
中钡的含量的原理和方法。
2.掌握晶形沉淀的制备、过滤、洗涤、灼烧及恒重的基本操作技术。
3. 了解微波技术在样品干燥方面的应用。
二.实验原理
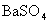 重量法既可用于测定
重量法既可用于测定 的含量,也可用于测定
的含量,也可用于测定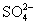 的含量。
的含量。
称取一定量的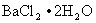 ,以水溶解,加稀HCl溶液酸化,加热至微沸,在不断搅动的条件下,慢慢地加入稀、热的
,以水溶解,加稀HCl溶液酸化,加热至微沸,在不断搅动的条件下,慢慢地加入稀、热的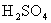 ,
, 与
与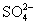 反应,形成晶形沉淀。沉淀经陈化、过滤、洗涤、烘干、炭化、灰化、灼烧后,以
反应,形成晶形沉淀。沉淀经陈化、过滤、洗涤、烘干、炭化、灰化、灼烧后,以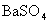 形式称量。可求出
形式称量。可求出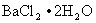 中钡的含量。
中钡的含量。
 可生成一系列微溶化合物,如
可生成一系列微溶化合物,如 ,
,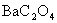 ,
,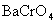 ,
, ,
,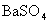 等,其中以
等,其中以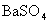 溶解度最小,100mL溶液中,100℃时溶解0.4mg,25℃时仅溶解0.25mg。当过量沉淀剂存在时,溶解度大为减小,一般可以忽略不计。
溶解度最小,100mL溶液中,100℃时溶解0.4mg,25℃时仅溶解0.25mg。当过量沉淀剂存在时,溶解度大为减小,一般可以忽略不计。
硫酸钡重量法一般在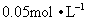 左右盐酸介质中进行沉淀,这是为了防止产生
左右盐酸介质中进行沉淀,这是为了防止产生 ,
, ,
,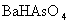 沉淀以及防止生成
沉淀以及防止生成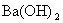 共沉淀。同时,适当提高酸度,增加BaSO4在沉淀过程中的溶解度,以降低其相对过饱和度,有利于获得较好的晶形沉淀。
共沉淀。同时,适当提高酸度,增加BaSO4在沉淀过程中的溶解度,以降低其相对过饱和度,有利于获得较好的晶形沉淀。
用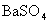 重量法测定
重量法测定 时,一般用稀
时,一般用稀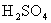 作沉淀剂。为了使
作沉淀剂。为了使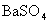 沉淀完全,
沉淀完全,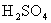 必须过量。由于
必须过量。由于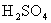 在高温下可挥发除去,故沉淀带下的
在高温下可挥发除去,故沉淀带下的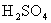 不会引起误差,因此沉淀剂可过量50%~100%。
不会引起误差,因此沉淀剂可过量50%~100%。
但由于本实验采用微波炉干燥恒重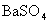 沉淀,若沉淀中包藏有
沉淀,若沉淀中包藏有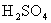 等高沸点杂质,利用微波加热技术干燥
等高沸点杂质,利用微波加热技术干燥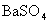 沉淀过程中杂质难以分解或挥发。因此,对沉淀条件和洗涤操作等的要求更高,主要包括将含
沉淀过程中杂质难以分解或挥发。因此,对沉淀条件和洗涤操作等的要求更高,主要包括将含 试液进一步稀释,过量沉淀剂(
试液进一步稀释,过量沉淀剂(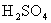 )控制在20%~50%以内等。
)控制在20%~50%以内等。
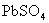 ,
,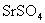 的溶解度均较小,
的溶解度均较小,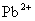 ,
,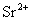 对钡的测定有干扰。
对钡的测定有干扰。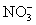 ,
,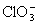 ,
, 等阴离子和
等阴离子和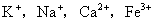 等阳离子均可以引起共沉淀现象,故应严格控制沉淀条件,减少共沉淀现象,以获得纯净的
等阳离子均可以引起共沉淀现象,故应严格控制沉淀条件,减少共沉淀现象,以获得纯净的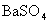 晶形沉淀。
晶形沉淀。
三.主要试剂和仪器
1. 
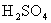
2.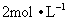
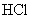
3.分析纯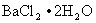 固体
固体
4.微波炉
5.循环真空水泵
6. 号微化玻璃坩埚
号微化玻璃坩埚
四.实验步骤
1.称样及沉淀的制备
…… …… 余下全文
钡盐中钡含量的测定
(沉淀重量法)
一、实验目的
1. 熟悉晶形沉淀条件及方法;
2.掌握沉淀的过滤、洗涤和灼烧等基本操作;
3. 测定氯化钡中钡含量。
二、仪器与试剂
分析天平;长颈漏斗;玻璃棒;烧杯;滴管;电炉;瓷坩埚;马福炉;干燥器;定量滤纸等。
BaCl2·2H2O试样;HCl(2mol·L-1);
H2SO4(1mol·L-1);AgNO3(1mol·L-1)。
三、实验原理
1.Ba2+能生成一系列难溶化合物,如BaCO3、BaC2O4、BaCrO4和BaSO4等,其中以BaSO4的溶解度最小(Ksp=1.1×10-10),且很稳定,其组成与化学式相符,符合重量分析对沉淀的要求。
2.BaSO4是典型的晶形沉淀,因此应完全按照晶形沉淀的处理方法,将所得沉淀经陈化后,过滤、洗涤、干燥和灼烧,最后以硫酸钡沉淀形式称量,求得试样中Ba2+的含量。
3.可溶性硫酸盐试样溶于水中,用稀盐酸酸化,加热近沸并在不断搅拌的情况下,缓慢地加入热的沉淀剂—稀H2SO4溶液,使生成难溶性硫酸钡沉淀。
4.反应式:Ba2+ + SO42- = BaSO4↓(白)
四、实验步骤
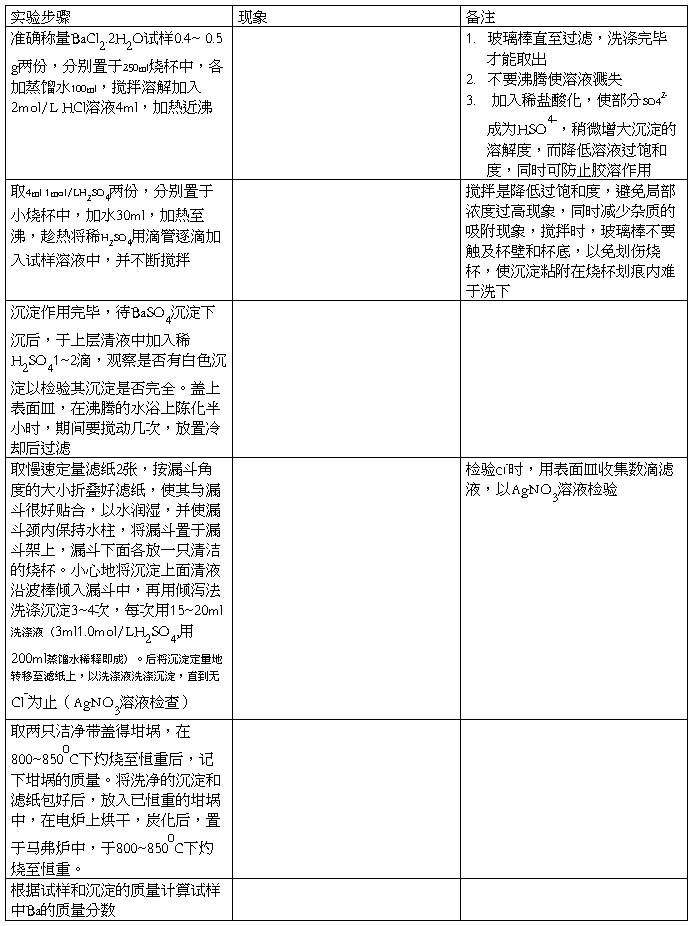
1.称样及沉淀的制备
准确称取 BaCl2. 2H2O 试样 0.4~0.5 g,置于250mL烧杯中,加100 mL水搅拌溶解。加入 4mL
2 mol·L-1HCl,加热近沸。
取4mL l mol·L-1 H2SO4于100mL烧杯中,加水30mL,加热至近沸。趁热将稀 H2SO4用滴管逐滴
加入至试样溶液中。沉淀作用完毕,待BaSO4沉淀下沉后,于上层清夜中加入稀H2SO41~2滴检验沉淀是否完全。沉淀完全后,盖上表面皿,放在沸水浴上,经常搅拌并保温陈化30min,冷却后过滤。
2.沉淀的过滤和洗涤
用慢速定量滤纸进行倾泻法过滤,用稀 H2SO4溶 液(3mL 1 mol·L 的H2SO4,用200mL水稀释既成)在烧杯中洗涤沉淀3~4次,然后,小心将沉淀定量转移到滤纸上,用洗涤液洗涤漏斗中的沉淀及滤纸直到无Cl-1为止。
…… …… 余下全文
沉淀重量法:加入适量的沉淀剂使被测组分沉淀出来,后转化为称量形式,求得被测组分的含量。
要求:①沉淀的溶解度要小;②沉淀易于过滤和洗涤;③沉淀要纯净,没沉淀剂和杂质,易转变为称量形式;;④称量形式要具有确定的化学组成;⑤足够的稳定性;⑥比较大的摩尔质量
一 实验原理
Ba2+能生成BaCO3,BaCrO4,BaSO4,BaC2O4等一系列难容化合物,其中BaSO4的溶解度最小(Ksp=1.1x10-10),其组成与化学式符合,摩尔质量较大,性质稳定,符合重量分析对沉淀的要求。因此通常与BaSO4沉淀形式和称量形式测定Ba2+。为获得颗粒较大和纯净的BaSO4晶体沉淀,试样溶于水后;加HCl酸化,SO42+ + H+=HSO4-,以降低溶液的相对过饱和度,同时可防止其他的弱酸盐生成。加热近沸,在不断搅动下缓慢地加适当过量的沉淀剂稀H2SO4形成的BaSO4沉淀颈陈化,过滤,洗涤,灼烧后,以BaSO4形式称量,即可求得试样中Ba的含量。
二 仪器和试剂
瓷坩埚,漏斗,马弗炉,定量滤纸,BaCl2●2H2O,HCl溶液2mol/L,H2SO4溶液1mol/L,AgNO3溶液0.1mol/L。
三
四 注意事项
测定误差主要来源沉淀的溶解损失,粘污和称量。玻璃棒不断搅拌的目的是防止沉淀附在玻璃棒上,洗涤沉淀时,少量多次,是减少沉淀量的损失。
五 数据记录
…… …… 余下全文
水中钙镁含量的测定实验报告
试验时间:2014.04.11 报告人:武伟
一、 目的要求
1. 掌握配位滴定的基本原理,方法和计算。
2. 掌握铬黑T、钙指示剂的使用条件和终点变化。
二、 实验原理
用EDTA测定水中钙镁含量时,通常在两个等分溶液中分别测定钙及钙镁的总量,镁的含量则从两者所用EDTA的差值求出。(详细原理见预习报告)
三、 实验用品
6 mol/L氢氧化钠,N 缓冲溶液,铬黑T试剂,钙指示剂,滴定管,25 mL移液管,锥形瓶6个
缓冲溶液,铬黑T试剂,钙指示剂,滴定管,25 mL移液管,锥形瓶6个
四、 实验内容
i. 实验步骤
…… …… 余下全文
实验题目:二水合氯化钡中钡含量的测定
(硫酸钡晶形沉淀分析法)
二、实验目的
1.了解测定BaCl2·2H2O中钡含量的原理和方法;
2.掌握晶形沉淀的制备、过滤、洗涤、灼烧及恒重等的基本操作;
3.了解重量分析方法的要求和操作要点。
三、实验原理
对于重量分析法,是根据待测元素或原子基团在特定条件下与其它物质相互作用而生成沉淀,将生成的沉淀经过陈化、烘干等过程处理后,称取其质量,从而根据反应关系计算得出要测元素含量的一种方法。
BaSO4重量法既可用于测定Ba+,也可用于测定SO2-4的含量。称
取一定量的BaCl2·2H2O用水溶解,加稀HCl酸化,加热至微沸,不断搅拌下加入稀、热的H2SO4,Ba+与SO2-4反应后形成晶形沉淀。沉
淀经过陈化、过滤、洗涤、烘干、炭化、灼烧后,以BaSO4形式称量,可求出BaCl2·2H2O中Ba的含量。
反应过程中,Ba+可生成一系列微溶化合物,另外NO、Cl-等会-
3
与K+、Fe3+形成共沉淀现象,从而影响实验结果测定,所以应严格把握实验条件,以期减少对测定结果的干扰。
四、主要试剂与器材
,0.1mol/L ;HCl 2mol/L ;分析纯H2SO4 1mol/L
瓷坩埚 ;马福炉 ;分析天平。
五、实验内容 BaCl2·2H2O;
1.称样及沉淀的制备:准确称取约0.41gBaCl2·2H2O试样,置
于250mL烧杯中,加入约100mL水,3mLHCl溶液,搅拌溶解,加热至近沸。另取4mL 1mol/L H2SO4于100mL烧杯中,加水30mL加热至
近沸,趁热将H2SO4溶液用滴管逐滴加入到热的钡盐溶液中,并用玻
璃棒不断搅拌,直至加完为止。用H2SO4检查上清液,沉淀完全后盖
上表面皿,将沉淀放置一晚,陈化。
2.沉淀的过滤和洗涤:用中速滤纸倾泻法过滤,用稀H2SO4(1mL
…… …… 余下全文

实验四 钻井液中固相含量的测定
一.实验目的
1.掌握固相含量测定仪的操作方法。
2.学会钻井液中固相含量的计算方法。
二.实验原理
根据蒸馏原理,取一定量钻井液用电热器将其蒸干,收集并测出冷凝的体积,用减差法即可求出钻井液中固相含量。也可通过称重方法算出其固相含量。
三.实验仪器
ZNC型固相含量测定仪;电动搅拌器;台称;量筒。
四.实验步骤
1.拆开蒸馏器,称出蒸馏杯重量:W杯(克)
2.用注射器取10毫升均匀钻井液样,注入蒸馏水杯中,称重W杯+浆(克)。
3.将套筒及加热棒拧紧在蒸馏杯上,再将蒸馏器引流管插入冷凝器出口端。
4.将加热棒插头插入电线插头,通电加热蒸馏,并计时间。通电约3~5分钟后冷凝液即可滴入量筒,连续蒸馏至不再有液体滴出为止,切断电源。
5.用环架套住蒸馏器上部,使其与冷凝分开,再用湿布冷却蒸馏器。
6.记下量筒中馏出液体体积毫升数,若馏出物为水与油且分层不清时可加入1~3滴破乳剂。油、水体积分别以V油、V水表示。
7.取出加热棒,用刮刀刮净套筒内壁及加热棒上附者的固体,全部收集于蒸馏杯中,然后称重W杯+固(克)。
注意事项:
1.操作时蒸馏器必须竖直。
2.蒸馏时间一般为20分钟,不应超过30分钟。
3.注意保护加热棒和用电安全。
4.若钻井液泡多,可加数滴消泡剂。
五.实验数据处理:
设为淡水非加重钻井液:
固相质量体积百分含量(W杯+浆-W杯)×10(克/100ml)
固相体积百分含量 = 固相质量体积百分含量÷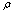 土(ml/100ml)
土(ml/100ml)
注:粘土比重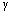 土=2.5。
土=2.5。
六.实验数据计算
原始数据记录表
表1 泥浆中固相含量的测定

泥浆的质量(W杯+浆-W杯)=115.25-105.04=10.21g
干馏后固体的质量(W杯+固-W杯)=105.43-105.04=0.39g
…… …… 余下全文
