琼脂糖凝胶电泳实验
20##-11-03 09:43:56 来源:生物秀 评论:0 我要评论
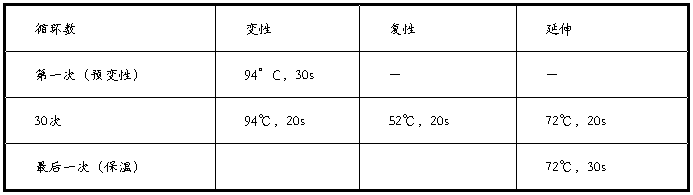
实验二琼脂糖凝胶电泳实验【实验目的】(1) 学习琼脂糖凝胶电泳的基本原理;(2) 掌握使用水平式电泳仪的方法;(3) 学习在含有甲醛的凝胶上进行RNA电泳的方法。【实验原理】琼脂糖凝胶电泳是基因工程实验室中分离鉴定核酸的常规方法。核酸是两性电解质,其等电点为pH2-2.5,在常规的…

凝胶加样缓冲液

使用以上凝胶加样缓冲液的目的有三:增大样品密度;以确保DNA均匀进入样品孔内;使样品呈现颜色,从而使加样操作更为便利,含有在电块中能以可预知速率向阳极泳动的染料。溴酚蓝在琼脂糖中移动的速率约为二甲苯青FF的2.2倍,而与琼脂糖浓度无关。以0.5×TBF作电泳液时,溴酚蓝在琼脂糖中的泳动速 率约与长300bp的双链线状DNA相同,而二甲苯青FF的泳动则与长4kb的双链线状DNA相同。在琼脂糖浓度为0.5%~1.4%的范围内,这些对应 关系受凝胶浓度变化的影响并不显著。
选用哪一种加样染料纯属个人喜恶。但是,对于碱性凝胶应当使用溴甲酚绿作为示踪染料,因为在碱性pH条件下其显色较溴酚更蓝为鲜明。
…… …… 余下全文