实验六 磷酸的电位滴定
应化1101 夏海琴 2014.11.13
一、实验目的
1. 掌握酸度计测量溶液pH和雷磁ZDJ-4A自动电位滴定仪的操作要点。
2. 了解电位滴定法的基本原理。
3. 学习使用Excel或Origin软件处理NaOH滴定磷酸的数据和绘图。更直观地观察滴定曲线中的两个突跃,学会计算相应的两级解离常数。
4. 掌握用三切线法及一级、二级微商来处理实验数据和分析实验结果。
二、实验原理
电位滴定法是根据滴定过程中,指示电极的电位或pH产生“突变”,从而确定滴定终点的一种分析方法。
在以NaOH滴定H3PO4时,将饱和甘汞电极及玻璃电极插入待测溶液中,使之组成原电池:
Ag | AgCl,HCl (0.1 mol/L) | 玻璃膜 | 被测试液 || KCl ( >3.5 mol/L),HgCl2 | Hg
 H+ 盐桥
H+ 盐桥
 玻璃电极 甘汞电极
玻璃电极 甘汞电极
被测试液
由于玻璃薄膜上的阳离子能与溶液中的H+产生离子交换而产生电势,因而称玻璃电极为指示电极,甘汞电极为参比电极,当NaOH溶液不断滴入试液中,溶液H+的活度随着改变,电池的电势也不断变化,可用能斯特(Nernst)公式表示为
E电池= ΔEθ – 0.059V lgαH+ 或E电池= ΔEθ + 0.059V pH
…… …… 余下全文



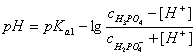 (1)
(1)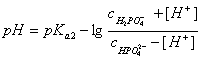 (2)
(2) 院系:医学检验系 班级:11检验本科1班 姓名:****
院系:医学检验系 班级:11检验本科1班 姓名:****