

…… …… 余下全文
实验5 电位滴定法测定醋酸的含量
一、实验目的
1、熟悉电位滴定的基本原理和操作技术;
2、学习运用二级微商法确定滴定的终点。
二、实验原理
醋酸为有机酸(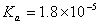 ),与NaOH的反应为:
),与NaOH的反应为: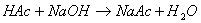 。用与已知浓度的NaOH滴定未知浓度的HAc溶液在终点时产生pH(或mV)值的突跃,因此根据滴定过程中pH(或mV)值的变化情况来确定滴定的终点,进而求得各组份的含量。
。用与已知浓度的NaOH滴定未知浓度的HAc溶液在终点时产生pH(或mV)值的突跃,因此根据滴定过程中pH(或mV)值的变化情况来确定滴定的终点,进而求得各组份的含量。
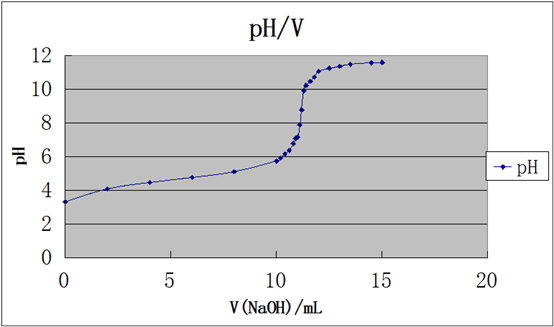
滴定终点可由电位滴定曲线(指示电极电位或该原电池的电动势对滴定剂体积作图)来确定,也可以用二次微商曲线法求得。二次微商曲线法是一种不需绘图,而通过简单计算即可求得滴定的终点,结果比较准确。这种方法是基于在滴定终点时,电位对体积的二次微商值等于零。
例:用下表的一组终点附近的数据,求出滴定终点
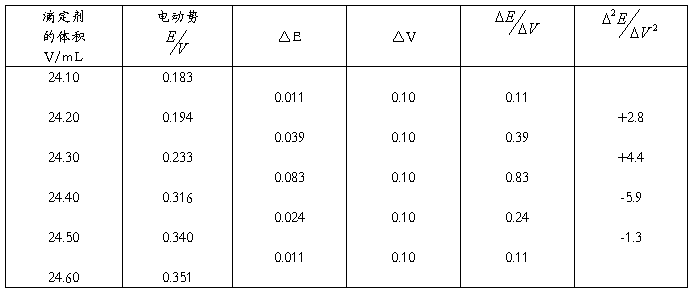
表中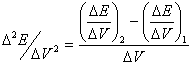
加入△V为等体积,在接近滴定终点时。
从表中 的数据可知,滴定终点在24.30mL与24.40mL之间。
的数据可知,滴定终点在24.30mL与24.40mL之间。
设: (24.30+X)mL时为滴定的终点
 即为滴定终点。
即为滴定终点。
则有: 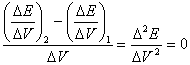
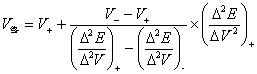
即: 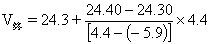
所以在滴定终点时滴定剂的体积应为: 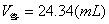
三、仪器和试剂
1、仪器 酸度计(含复合电极)
电磁搅拌器(含搅拌子)
滴定管
100µL进样器
铁架台(含滴定管夹)
…… …… 余下全文
实验五乙酸的电位滴定分析及其离解常数的测定
一、实验目的
(1)学习电位滴定的基本原理和操作技术。
(2)运用pH-V曲线法确定滴定终点。
(3)学习弱酸离解常数的测定方法。
二、实验原理
乙酸CH3COOH(简写为HAc)为一种弱酸,其pKa = 4.74,当以标准碱溶液滴定乙酸试液时,在化学计量点附近可以观察到pH值的突跃。
在试液中插入复合玻璃电极,即组成如下工作电池:

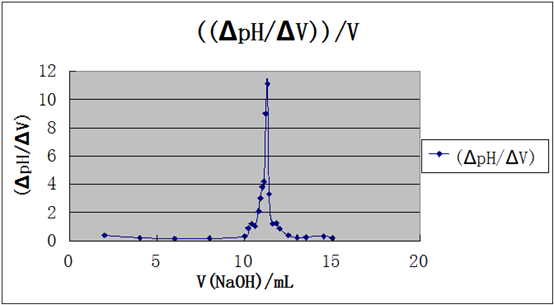
该工作电池的电动势在pH计上表示为滴定过程中的pH值,记录加入标准碱溶液的体积V和相应被滴定溶液的pH值,然后由pH-V曲线或(△pH/△V)-V曲线来求得终点时消耗的标准碱溶液的体积,也可用二次微分法,于△2pH/△V2=0处确定终点。根据标准碱溶液的浓度、消耗的体积和试液的体积,即可求得试液中乙酸的浓度或含量。
根据乙酸的离解平衡:
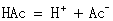
其离解常数:
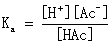
当滴定分数为50%时,[HAc] =[Ac-],此时
 , 即
, 即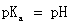
因此,在滴定分数为50%处的pH值,即为乙酸的pKa值。
三、仪器
1. pH计,复合玻璃电极。
2. 50mL容量瓶,5mL移液管,20mL碱式滴定管。
四、试剂
1. 0.1000 mol/L草酸标准溶液;
2. 0.1 mol/L NaOH标准溶液(浓度待标定);
3. 乙酸试液(浓度约0.1 mol/L);
4. 0.05 mol/L邻苯二甲酸氢钾溶液,pH=4.00(20℃);
5. 0.05 mol/L Na2HPO4 + 0.05 mol/L KH2PO4混合溶液,pH =6.88(20℃)。
五、实验步骤
1. 打开pH计电源开关,预热30min。接好复合玻璃电极。
2. 用pH=6.88(20℃)和pH=4.00(20℃)的缓冲溶液对pH计进行两点定位。
3. NaOH溶液的标定
准确吸取5.00mL草酸标准溶液于50mL小烧杯中,再加水约25mL。放入搅拌磁子,浸入pH复合电极。开启电磁搅拌器(注意磁子不能碰到电极),用待标定的NaOH溶液进行滴定,1mL读数一次,在滴定终点体积Vep处和化学计量点附近时(即pH变化较快时),每隔0.10mL读数一次,记录每个点对应的体积和pH值。
…… …… 余下全文
白醋中总酸含量测定的实验报告
贵溪市第一中学
实验组员:程宇航 叶子函 指导教师:夏如意
实验目的:
测定白醋中的总酸含量
在强酸滴定强碱的基础上掌握用NaOH溶液滴定醋酸(弱酸)的反应原理,
了解强碱滴弱酸时指示剂的选择,
学习自主设计实验方案并优化方案的方法,
巩固一定物质的量浓度溶液的配制的操作技能
巩固和拓展中和滴定的操作技能,
了解实验数据的处理方法,
了解误差的分析方法。
前期准备:
通过查找资料得知,【乙酸】CH3COOH,又名醋酸,无色澄清液体,有强烈的刺激性气味。Mr60.05,mp16.7℃,bp118℃,相对密度1.049。
醋是乙酸的3%~5%(质量分数)的水溶液。每100mL醋中的醋酸含量,普通醋为3.5g以上,优级醋为5g以上。除乙酸外,一般还含有其他的酸,具体有氨基酸,乳酸(2-羟基丙酸,丙醇酸CH3CHOHCOOH),丙酮酸(乙酰甲酸CH3COCOOH),甲酸(蚁酸HCOOH),山梨酸(2,4-己二烯酸)苹果酸(羟基丁二酸),柠檬酸(2-羟基丙三羧酸),琥珀酸酸(丁二酸HOOCCH2CH2COOH),草酸(乙二酸HOOCCOOH)等。
实验原理:
化学反应原理:食醋中含醋酸(CH3COOH)3%~5%(质量/体积),此外还有少量乳酸等有机弱酸。用NaOH溶液滴定时,实际测出的是总酸量,即食品中所有酸性成分的总量,包括未离解的酸和已离解的酸,而分析结果通常用含量最多的醋酸来表示。它们与NaOH溶液的反应为:CH3COOH NaOH=CH3COONa H2O。
由于是强碱滴定弱酸,滴定的pH突变在碱性范围内,理论上滴定终点的pH在8.7左右。通常用酚酞作指示剂,滴至溶液呈粉红色且30 s内不褪色,表明达到滴定终点。
实验仪器与药品:
仪器:托盘天平(含砝码)、酸式滴定管、碱式滴定管、锥形瓶、烧杯、玻璃棒、胶头滴管、试剂瓶、吸量管、滴瓶、药匙、洗耳球。
…… …… 余下全文
实验 电位滴定法测定酱油中氨基酸态氮的含量
一、实验目的
1. 掌握滴定法测定氨基酸总量的原理
2. 了解电位滴定法确定酸碱滴定终点原理
3. 熟练使用酸度计。
二、实验原理
氨基酸含有酸性的一COOH,也含有碱性的一NH2。它们互相作用使氨基酸成为中性的内盐。加入甲醛溶液时,-NH2与甲醛结合,其碱性消失。这样就可以用碱来滴定一COOH,并用间接的方法测定氨基酸的含量。将酸度计的玻璃电极及甘汞电极(或复合电极)插入被测液中构成电池,用碱液滴定,根据酸度计指示的pH值判断和控制滴定终点.
三、仪器与试剂
1. 仪器
酸度计、复合玻璃电极、磁力搅拌器 烧杯(200mL) 微量滴定管(10ml) 2. 试剂
① 20%中性甲醛
② 0.05mol/L氢氧化钠标准溶液
③ pH=6.18标准缓冲溶液
四、实验步骤
1. 仪器校正:
开启酸度计电源,预热30分钟,连接复合电极。选择适当pH的缓冲溶液,测量缓冲溶液的温度,调节温度补偿旋钮至实际温度。将电极浸入缓冲溶液中,调节定位旋钮,使酸度计显示的pH值与缓冲溶液的pH值相符。校正完后定位调节旋钮不可再旋动,否则必须重新校正。 2. 样品处理
准确称取约5.0g酱油试样,置于100mL容量瓶中,加水至刻度,混匀后吸取20.0mL,置于200mL烧杯中,加60mL水,开动磁力搅拌器,用氢氧化钠标准溶液[c(NaOH)=0.050 mol/L]滴定至酸度计指示pH8.2,记下消耗氢氧化钠标准滴定溶液(0.05 mol/L)的毫升数,可计算总酸含量。
1
3. 氨基酸的滴定
在上述滴定至pH8.2的溶液中加入10.0mL甲醛溶液,混匀。再用氢氧化钠标准滴定溶液(0.05mol/L)继续滴定至PH9.2,记下消耗氢氧化钠标准滴定溶液(0.05mol/L)的毫升数( V1)。
4. 空白实验
同时取80mL蒸馏水置于另一200mL烧杯中,先用0.05mo1/L氢氧化钠标准溶液滴至pH8.2(此时不记碱消耗量),再加入10.0mL中性甲醛溶液,混匀。用0.05mo1/L的氢氧化钠标准溶液继续滴定至pH9.2,记录消耗氢氧化钠标准溶液的体积( V2)。此为试剂空白实验。
…… …… 余下全文
乙酸的电位滴定分析及其离解常数的测定
一、实验目的
(1)学习电位滴定的基本原理和操作技术。
(2)运用pH-V曲线法确定滴定终点。
(3)学习弱酸离解常数的测定方法。
二、实验原理
乙酸CH3COOH(简写为HAc)为一种弱酸,其pKa = 4.74,当以标准碱溶液滴定乙酸试液时,在化学计量点附近可以观察到pH值的突跃。
在试液中插入复合玻璃电极,即组成如下工作电池:

该工作电池的电动势在pH计上表示为滴定过程中的pH值,记录加入标准碱溶液的体积V和相应被滴定溶液的pH值,然后由pH-V曲线或(△pH/△V)-V曲线来求得终点时消耗的标准碱溶液的体积,也可用二次微分法,于△2pH/△V2=0处确定终点。根据标准碱溶液的浓度、消耗的体积和试液的体积,即可求得试液中乙酸的浓度或含量。
根据乙酸的离解平衡:
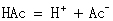
其离解常数:
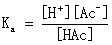
当滴定分数为50%时,[HAc] =[Ac-],此时
 , 即
, 即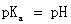
因此,在滴定分数为50%处的pH值,即为乙酸的pKa值。
三、仪器
1. pH计,复合玻璃电极。
2. 50mL容量瓶,5mL移液管,20mL碱式滴定管。
四、试剂
1. 0.1000 mol/L草酸标准溶液;
2. 0.1 mol/L NaOH标准溶液(浓度待标定);
3. 乙酸试液(浓度约0.1 mol/L);
4. 0.05 mol/L邻苯二甲酸氢钾溶液,pH=4.00(20℃);
5. 0.05 mol/L Na2HPO4 + 0.05 mol/L KH2PO4混合溶液,pH =6.88(20℃)。
五、实验步骤
1. 打开pH计电源开关,预热30min。接好复合玻璃电极。
2. 用pH=6.88(20℃)和pH=4.00(20℃)的缓冲溶液对pH计进行两点定位。
3. NaOH溶液的标定
准确吸取5.00mL草酸标准溶液于50mL小烧杯中,再加水约25mL。放入搅拌磁子,浸入pH复合电极。开启电磁搅拌器(注意磁子不能碰到电极),用待标定的NaOH溶液进行滴定,1mL读数一次,在滴定终点体积Vep处和化学计量点附近时(即pH变化较快时),每隔0.10mL读数一次,记录每个点对应的体积和pH值。
…… …… 余下全文
电位滴定法测定食醋中醋酸的含量
一、实验目的
1 通过醋酸的电位滴定,掌握电位滴定的基本操作、PH的变化及指示剂的选择。
2 学习食用醋中醋酸含量的测定方法。
二、实验原理
食用醋的主要酸性物质是醋酸(HAC),此外还含有少量其他的弱酸。醋酸的解离常数Ka=1.8×10-5,用NaOH标准溶液滴定醋酸,化学计量点的PH为8.7,可选用酚酞作指示剂,滴定终点时溶液由无色变为微红色。两者的反应方程式为:HAc + NaOH = NaAc + H2O。然而在本实验滴定过程中,由于食用醋的棕色无法使用合适的指示剂来观察滴定终点,所以它的滴定终点用酸度计来测量。
本实验选用邻苯二甲酸氢钾(KHP)作为基准试剂来标定氢氧化钠溶液的浓度。邻苯二甲酸氢钾纯度高、稳定、不吸水、而且有较大的摩尔质量。标定时可用酚酞作指示剂
三、主要试剂和仪器
1 仪器:pHS-2C型酸度计、天平、电子分析天平、电磁搅拌器、容量瓶(150ml)、锥形瓶(250ml)、吸量管(5.0ml ,25ml)、碱式滴定管、烧杯(250ml)、量筒(50ml)
2 试剂:NaOH、KHC8H4O4基准物质、食用醋、酚酞、去离子水
四、实验内容和步骤
1 酸度计的安装与校正
(1)开机预热30min,连接复合电极,安排好滴定管和酸度计的位置
(2)用标准缓冲溶液校准仪器(测定前要开动搅拌器):将搅拌棒放入标准缓冲溶液中,把电极插入溶液中使玻璃球完全浸没在溶液中,开动搅拌器,注意观察磁棒不要碰到电极。
(3)pH6.86标准缓冲溶液定位:先将斜率旋钮顺时针调到最大,调节pHl量程至6,按下读数开关,将定位旋钮调至pH至标准缓冲溶液pH值。
(4)pH9.18标准缓冲溶液调斜率:调节pH量程至8,按下读数开关,将斜率旋钮调至pH至标准缓冲溶液pH值。
(5)pH6.86标准缓冲溶液定位:再调节pH量程至6,按下开关读数,将定位旋钮调至pH至标准缓冲溶液pH值。
…… …… 余下全文
实验四 乙酸的电位滴定分析及其解离常数的测定
一、目的要求
1.学习电位滴定的基本原理及操作技术
2.运用pH-V曲线和(ΔpH-ΔV)-V曲线与二级微商法确定滴定终点。。
3.学习测定弱酸离解常数的方法。
二、实验原理
乙酸HAc是一弱酸,其pKa = 4.74,当以标准碱溶液滴定乙酸试液时,在化学计量点附近可以观察到pH的突跃。
以玻璃电极与饱和甘汞电极插入试液即组成如下的工作电池:
Ag,AgCl︱HCl(0.1 mol·L-1)︱玻璃膜︱HAc试液︱KCl(饱和)︱Hg2Cl2,Hg
该工作电池的电动势在酸度计上反映出来,并表示为滴定过程中的pH,记录加入标准碱溶液的体积V和相应的被滴定溶液的体积。也可用二级微商法,于Δ2pH-ΔV2=0处确定终点。根据标准碱溶液的浓度、消耗的体积和试液的体积,即可求得试液中乙酸的浓度或含量。
根据乙酸的解离平衡:
HAc(aq)  H+(aq) + Ac-(aq)
H+(aq) + Ac-(aq)
其解离常数

当滴定分数为50﹪时,[Ac-] = [HAc],此时Ka = [H+],即pKa = pH
因此在滴定分数为50﹪处的pH,即为乙酸的pKa。
三、仪器和试剂
1.酸度计
2.玻璃电极
…… …… 余下全文
