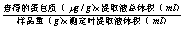实验7 考马斯亮蓝考G-250染色法测定蛋白质含量
一、目的
1、学习一种蛋白质染色测定的方法
2、掌握考马斯亮蓝法测定蛋白质含量的基本原理和方法
二、原理
蛋白质的存在影响酸碱滴定中所用某些指示剂的颜色变化,从而改变这些染料的光吸收。在些基础上发展了蛋白质染色测定方法。涉及的指示剂有甲基橙、考马斯亮蓝、溴甲酚绿和溴甲酚紫。目前广泛使用的染料是考马斯亮蓝。
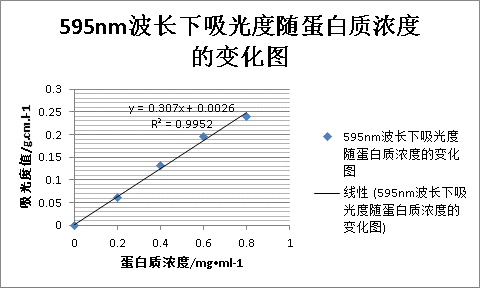
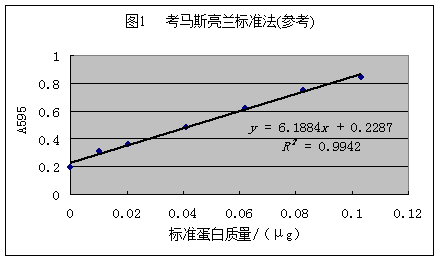
考马斯亮蓝G-250在酸性溶液中为棕红色,其所含疏水基团在酸性条件下与蛋白质的疏水区具有亲和力,通过疏水作用与蛋白质相结合,形成蓝色的蛋白质染料复合物,在595nm处有最大吸光度,在一定的蛋白质浓度范围内,蛋白质染料符合物在595nm处的吸光度与蛋白质杭亮成正比,因此可用于蛋白质含量测定。
反应2—5分钟即呈最大光吸收,至少稳定1小时。在0.01—1.0 mg蛋白质/ml范围内均可。该法操作简便迅速,消耗样品量少,但不同蛋白质之间差异大,且标准曲线线性差。高浓度的Tris、EDTA、尿素、甘油、蔗糖、丙酮、硫酸铵和去污剂时测定有干扰。缓冲液浓度过高时,改变测定液pH值会影响显色。考马斯亮蓝染色能力强,比色杯不洗干净会影响光吸收值,不可用石英怀测定。
三、材料、试剂与器具
(一)试剂
1、染色液:取考马斯亮蓝G-250 100mg溶于50ml 95%乙醇中,加100ml 85%磷酸,加水稀释至1升。棕色瓶保存,该染色液可保存数月,若不加水可长期保存,用前稀释。
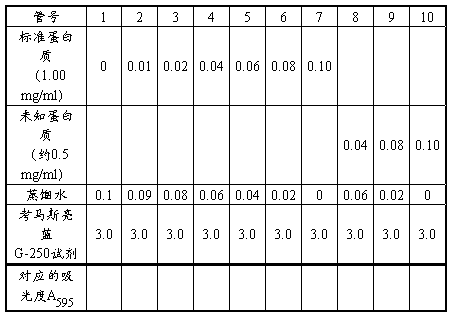
2、标准蛋白溶液:0.5mg/ml牛血清白蛋白。
3、未知浓度的蛋白质溶液用酪蛋白配制,浓度控制在10—30mg/ml
(二)器具
1、试管及试管架
2、移液管(1ml,5ml)
3、可见光分光光度计
四、操作步骤
(一)标准曲线的制作
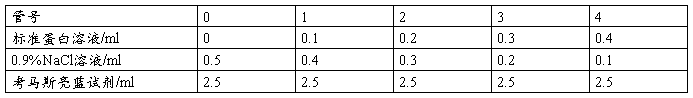
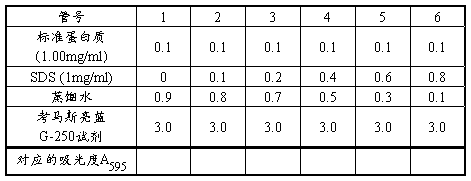
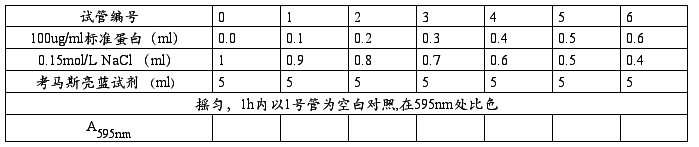
1、取7支试管,按下表加入试剂
…… …… 余下全文