实验六 醋酸电离度和电离常数的测定—pH法
一、实验目的
1.测定醋酸的电离度和电离常数;
2.学习pH计的使用。
[教学重点]
醋酸的电离度、电离常数的测定
[教学难点]
pH计的使用
[实验用品]
仪器:滴定管、吸量管(5mL)、容量瓶(50 mL)、pH计、玻璃电极、甘汞电极
药品:0.200 mol·L-1HAc标准溶液、0.200 mol·L-1NaOH标准溶液、酚酞指示剂、标准缓冲溶液(pH=6.86、pH=4.00)
二、基本原理
HAc → H++ Ac-
C:HAc的起始浓度;[H+]、[Ac-]、[HAc]:分别为平衡浓度;
α:电离数;K:平衡常数
α =  × 100%
× 100%
Ka = 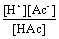 =
= 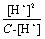
当α小于5时,C - [H+]≈C,所以Ka≈ 
根据以上关系,通过测定已知浓度HAc溶液的pH值,就可算出[H+],从而可以计算该HAc溶液的电离度和平衡常数。(pH=-lg[H+],[H+]=10-pH)
三、实验内容
1.HAc溶液浓度的测定(碱式滴定管)
以酚酞为指示剂,用已知浓度的NaOH溶液测定HAc的浓度。

2.配制不同浓度的HAc溶液
用移液管或吸量管分别取2.50 mL、5.00 mL、25.00 mL已测得准确浓度的HAc溶液,分别加入3只50 mL容量瓶中,用去离子水稀释至刻度,摇匀,并计算出三个容量瓶中HAc溶液的准确浓度。将溶液从稀到浓排序编号为:1、2、3,原溶液为4号。
3.测定HAc溶液的pH值,并计算HAc的电离度、电离常数
把以上四种不同浓度的HAc溶液分别加入四只洁净干燥的50 L杯中,按由稀到浓的顺序在pH计上分别测定它们的pH值,并记录数据和室温。将数据填入下表(p.129.),计算HAc电离度和电离常数。
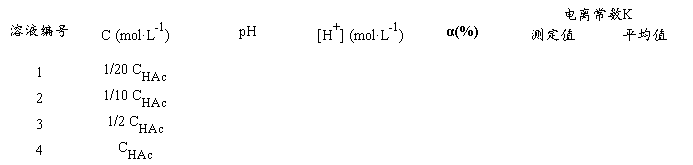
K值在1.0×10-5~2.0×10-5范围内合格(文献值25℃1.76×10-5)
…… …… 余下全文

 × 100%
× 100%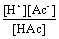 =
= 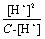


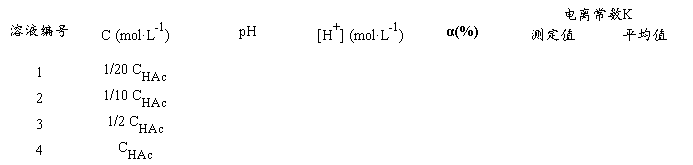
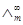 (S·m2·mol-1)
(S·m2·mol-1)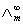 ,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率
,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率 (1)
(1) H+ + Ac-
H+ + Ac-  =
= 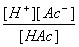 =
=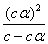 =
=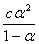 ,当α<5%时,1-α ≈1
,当α<5%时,1-α ≈1 
 标准NaOH溶液
标准NaOH溶液
 待测25.00mLHAc溶液
待测25.00mLHAc溶液