医疗器械不良事件年度汇总报告表 国家食品药品监督管理局制
报告人: 报告日期: 接受日期:
药品生产企业(签章) 省级ADR中心(签章) 国家ADR中心(签章)

…… …… 余下全文
医疗器械不良事件年度汇总报告表
报告时间: 年 月 日 编码:? ? ? ? ? ? ? ? ? ? ? 汇总时间: 年 月 日至 年 月 日


《医疗器械不良事件企业汇总报告表》填写说明
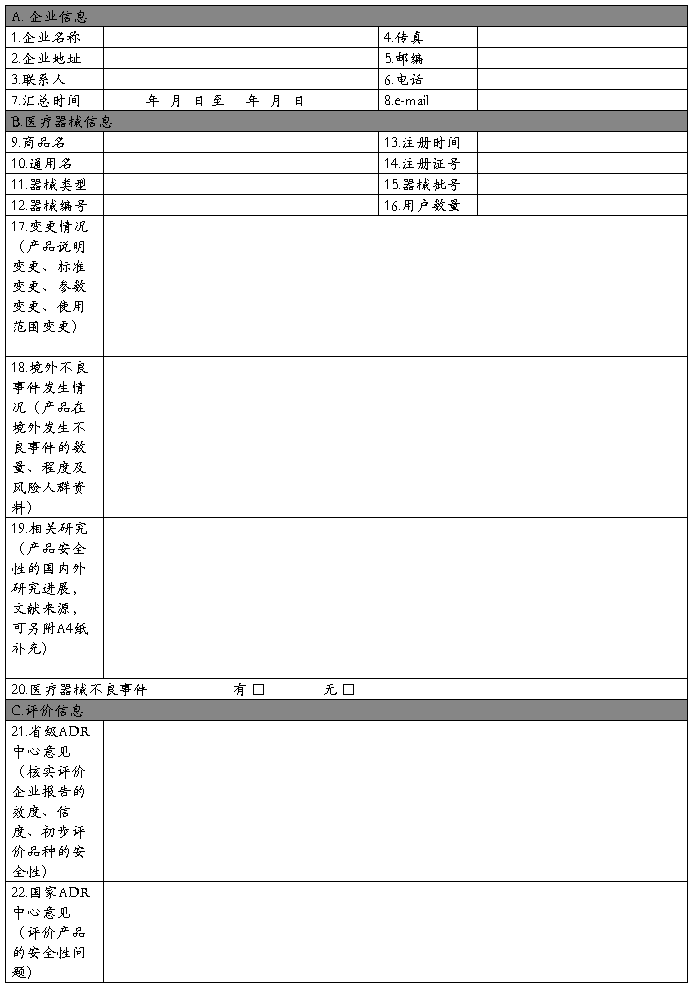
《医疗器械不良事件企业汇总报告表》由医疗器械国内生产企业、进口产品境内代表处或境内代理企业填写。
1.企业信息
第1条至第7条为企业信息,包括生产企业的名称、地址、联系人、联系方式,企业应提供确切的联系方式和具体联系人员,如果有变更及时更改。
2.医疗器械信息
第8条,填写汇总期间本企业生产、经营医疗器械的情况,需提供按医疗器械分类目录提供分类名称和相应医疗器械类型、商品名称、注册证号,其中器械类型是指一、二、三类医疗器械;
第9条,如果产品使用说明、标准、参数、使用范围发生变更,需要提供产品发生变更的项目和变更内容;
第10条,如果本企业生产、经营的医疗器械在境外发生医疗器械不良事件,需要警惕国内同类产品出现类似情况,需填写产品名称和事态发展、最可能发生的危害和最大能够发生的危害;
第11条, 医疗器械不良事件:选择有或无,选择有则填写第12条本企业生产经营医疗器械出现可疑医疗器械不良事件的情况汇总分析摘要。
3.报告方法:
可从广东省药品不良反应监测中心网站(http://www.)下载,或向广东省中心索取《可疑医疗器械不良事件报告表》。请将填写的报告表通过邮寄、传真或电子邮件方式提交省监测中心。
地址:510080 广州市东风东路753号之二 广东省食品药品监督管理局12楼 广东省药品不良反应监测中心医疗器械不良事件监测科;
联系电话:020-37886560 37885746;传真:020-37886560;
…… …… 余下全文
附件3:
医疗器械不良事件年度汇总报告表
报告时间: 年 月 日 编码:£ £ £ £ £ £ £ £ £ £ £
汇总时间: 年 月 日至 年 月 日

报告人: 省级监测技术机构接收日期: 国家监测技术机构接收日期:
生产企业(签章)
国家食品药品监督管理局制
…… …… 余下全文
编号:XXXXX
医疗器械不良事件年度汇总报告表
报告时间: 年 月 日 编码:
汇总时间: 年 月 日 至 年 月 日

报告人: 省级监测技术机构接收日期: 国家监测技术机构接收日期:
生产企业(签章)
国家食品药品监督管理局制
…… …… 余下全文
医疗器械不良事件报告表填写要求 主要内容:
第一部分:《可疑医疗器械不良事件报告表》
第二部分:《医疗器械不良事件补充报告表》
第三部分:《医疗器械不良事件年度汇总报告表》
第四部分:《医疗器械突发性群体不良事件基本信息表》
第一部分:《可疑医疗器械不良事件报告表》的填写要求
一、法规依据
《医疗器械不良事件监测和再评价管理办法(试行)》的第三章
第十一条 医疗器械生产企业、经营企业应当报告涉及其生产、经营的产品所发生的导致或者可能导致严重伤害或死亡的医疗器械不良事件。
医疗器械使用单位应当报告涉及其使用的医疗器械所发生的导致或者可能导致严重伤害或死亡的医疗器械不良事件。
报告医疗器械不良事件应当遵循可疑即报的原则。
第十二条 医疗器械生产企业、经营企业和使用单位发现或者知悉应报告的医疗器械不良事件后,应当填写《可疑医疗器械不良事件报告表》(附件1)向所在地省、自治区、直辖市医疗器械不良事件监测技术机构报告。其中,导致死亡的事件于发现或者知悉之日起5个工作日内,导致严重伤害、可能导致严重伤害或死亡的事件于发现或者知悉之日起1 5个工作日内报告。
(一)基本概念
医疗器械不良事件是指获准上市的、质量合格的医疗器械在正常使用情况下发生的,导致或可能导致人体伤害的任何有害事件。
严重伤害是指有下列情况之一者:
1、危及生命;
2、导致机体功能的永久性伤害或者机体结构的永久性损伤;
3、必须采取医疗措施才能避免上述永久性伤害或损伤。
(二)报告范围
1、死亡事件;
2、严重伤害事件;
3、可能导致死亡或者严重伤害事件。
(三)报告原则
1、基本原则
造成患者、使用者或其他人员死亡、严重伤害的事件,可能与使用医疗器械有关,需要按可疑医疗器械不良事件报告。
2、濒临事件原则
有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者或医务人员死亡或严重伤害,则也需要报告。
…… …… 余下全文
附件3:
上海市医疗器械不良事件年度汇总报告表
报告时间: 年 月 日 编码:£ £ £ £ £ £ £ £ £ £ £
汇总时间: 年 月 日至 年 月 日

报告人: 省级监测技术机构接收日期: 国家监测技术机构接收日期:
生产企业(签章)
弗锐达医疗器械技术服务有限公司
…… …… 余下全文
附件3:
医疗器械不良事件年度汇总报告表
报告时间: 年 月 日 编码:£ £ £ £ £ £ £ £ £ £ £
汇总时间: 年 月 日至 年 月 日

报告人: 省级监测技术机构接收日期: 国家监测技术机构接收日期:
生产企业(签章)
国家食品药品监督管理局制
…… …… 余下全文
