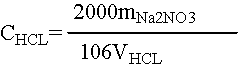实验五 盐酸标准溶液的配制和标定
一、实验目的
1. 掌握减量法准确称取基准物的方法。
2. 掌握滴定操作并学会正确判断滴定终点的方法。
3. 学会配制和标定盐酸标准溶液的方法。
二、实验原理
由于浓盐酸容易挥发,不能用它们来直接配制具有准确浓度的标准溶液,因此,配制HCl标准溶液时,只能先配制成近似浓度的溶液,然后用基准物质标定它们的准确浓度,或者用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比计算该溶液的准确浓度。
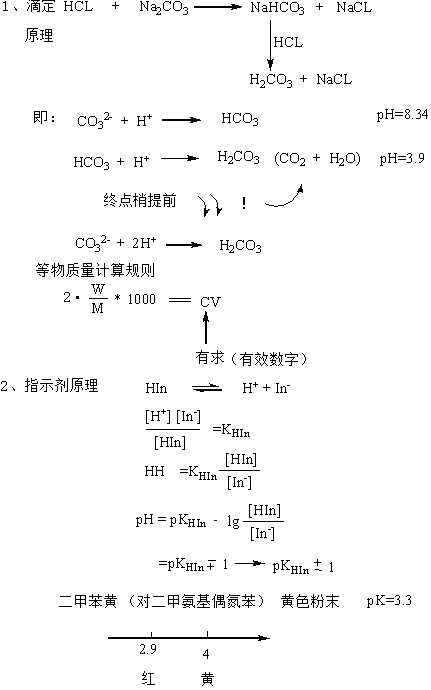
标定HCl溶液的基准物质常用的是无水Na2CO3,其反应式如下:
Na2CO3 +2HCl=2NaCl+CO2 +H2O
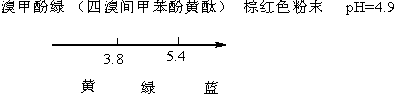
滴定至反应完全时,溶液pH为3.89,通常选用溴甲酚绿-甲基红混合液或甲基橙作指示剂。
三、仪器及试剂
仪器:25ml酸式滴定管、烧杯、锥形瓶、玻璃棒、250ml容量瓶
试剂:浓盐酸(密度1.19)、无水Na2CO3、甲基橙或者溴甲酚绿-甲基红混合液指示剂:量取30mL溴甲酚绿乙醇溶液(2g/L),加入20mL甲基红乙醇溶液(1g/L),混匀。
四、实验内容
(一)0.1mol·L-1盐酸标准溶液的配制:
量取2.2ml浓盐酸,注入250 mL水中,摇匀。装入试剂瓶中,贴上标签。
(二)盐酸标准溶液的标定:
准确称取0.19~0.21克 于270—300℃灼烧至质量恒定的基准无水碳酸钠,称准至0.0002 g,(至少二份)。溶于50mL水中,加2~3滴甲基橙作指示剂,用配制好的盐酸溶液滴定至溶液由黄色变为橙色,记下盐酸溶液所消耗的体积。同时作空白试验。(空白试验即不加无水碳酸钠的情况下重复上述操作。)
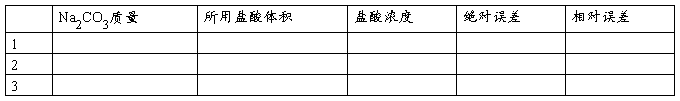
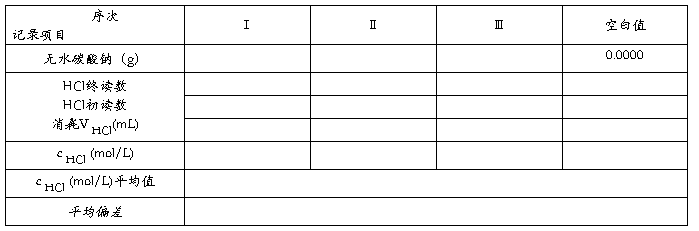
五、数据记录与处理
1.数据记录
2. 盐酸标准溶液的浓度计算式:
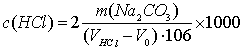
式中:c(HCl)——盐酸标准溶液之物质的量浓度,mol/L;
m——无水碳酸钠之质量,g
…… …… 余下全文

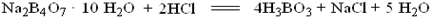
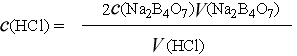
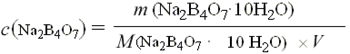
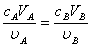
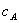 、
、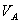 、
、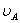 分别为酸的“物质的量”浓度、体积、化学计量系数;
分别为酸的“物质的量”浓度、体积、化学计量系数;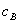 、
、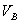 、
、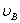 分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的化学计量系数由酸碱反应方程式决定。
分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的化学计量系数由酸碱反应方程式决定。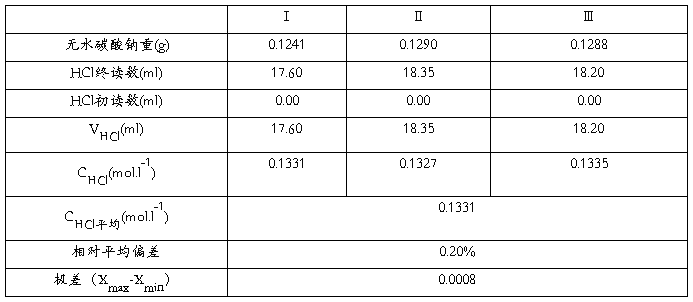
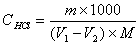
 。
。